Tema 2. Herencia.
Contenido
•Herencia mendeliana,
Primera ley: Segregación.
A Gregorio J. Mendel (1822-1884) se le considera el “Padre de la Genética” debido a los experimentos que realizó con el guisante o chícharo y a las conclusiones obtenidas que constituyen los fundamentos de la Genética Moderna.
Si bien, ya en su época se hacían experimentos sobre la herencia similares a los de Mendel, los datos que obtenían no permitían conjuntar una teoría que hiciera coherentes a todas las observaciones. El éxito de Mendel se debió a varias causas, algunas son:
a) La selección del material (la estructura anatómica de la planta; cultivo sencillo y tiempo de generación corto, que pudiera hibridarse artificialmente; en la naturaleza el guisante se autofecunda, pero experimentalmente es fácil realizar fecundaciones cruzadas, se reproduce bien y se hace adulto en una sola estación).
b) Registro de los caracteres en cada generación (anteriormente se consideraban los caracteres de varias generaciones).
c) La selección de caracteres sencillos (que fueran fáciles de identificar; semillas lisas o rugosos, de tallo corto o largo, etc, además, tuvo el cuidado de atender sólo a cada carácter y no a los organismos).
d) El empleo de las matemáticas que le permitió a Mendel completar una teoría que permitía explicar y prever los resultados.
El producto de sus experiencias en ocho años de trabajo y después de realizar millares de fecundaciones artificiales los expuso en 1865 ante la Sociedad de Historia Natural de Brünn en una memoria titulada: “Investigaciones de Hibridación en Plantas”. Este trabajo que consta apenas de unas cincuenta páginas revela los principios a los que Mendel llegó por la vía experimental de los cruzamientos del guisante cuando se desconocían todavía los cambios que sufren las células ( mitosis y meiosis), los cromosomas, gametos y genes).
Los caracteres con los que Mendel realizó sus observaciones y experimentos fueron siete pares:
1.- Forma de la semilla (lisa o rugosa) 2.- Color de la semilla (amarilla o verde) 3.- Color de la testa (coloreada o blanca) 4.- Forma de la vaina (inflada o constreñida) 5.- Color de la vaina (verde o amarilla) 6.- Posición de las flores (axilar o terminal) 7.- Longitud del tallo (largo o corto)
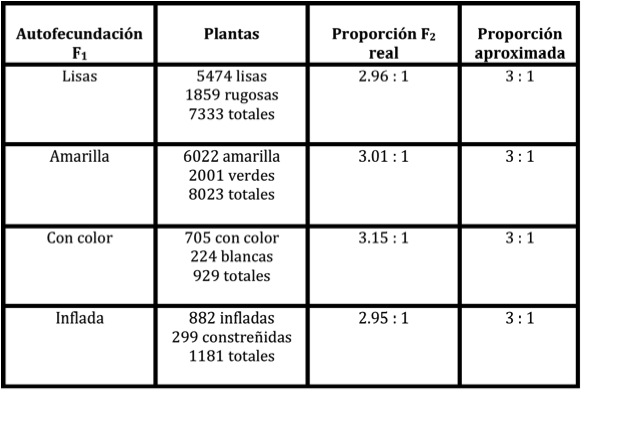
Al observar que había algunas plantas que tenían la forma de la semilla lisa y otras contrastaban con la forma de semilla rugosa (seguramente líneas puras “ya que el chícharo tiende a la autofecundación” normalmente) decidió polinizar una planta de semilla lisa con el polen de otra de semilla rugosa; encontró que toda la descendencia era de semilla lisa. Igual resultado obtuvo al polinizar la planta de semilla rugosa con polen de la planta de semilla lisa. Lo mismo hizo para determinar los demás caracteres y los resultados fueron semejantes. A las variedades puras que utilizó en el cruzamiento las consideró como progenitoras (P) y a la descendencia directa se le llamó primera generación filial (F1). Estos fueron los resultados.

Si Mendel hubiese realizado solamente estas observaciones las conclusiones a las que habría llegado no le hubieran permitido seguramente construir un modelo que le facilitara comprender la mecánica de la herencia. Así pues, el siguiente paso definitivo que dio Mendel fue el de permitir que las plantas de F1 se autofecundaran y a la generación resultante le llamo F2 (segunda generación filial) encontrando lo siguiente:
Al analizar sus resultados Mendel logró establecer ciertos principios que se repetían en todas las cruzas (algunos de estos principios ciertos autores los presentan como Leyes):
1.- Cada carácter viene dado por un par de factores (alelos) Ej. semilla lisa y rugosa, vaina amarilla y verde.
2.- En los caracteres (amarillo o verde, liso o rugoso, largo o corto, etc.) uno inhibe al otro cuando se unen (dominante es el carácter que se expresa y recesivo el que permanece latente).
3.- Los individuos guardan una constitución hereditaria (genotipo) y la expresión visible de los caracteres es el Fenotipo.
4.- En la segunda generación filial ¾ partes corresponden al carácter dominante y ¼ al carácter recesivo.
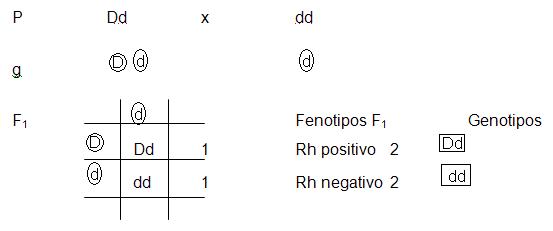
Cruzamiento monohíbrido
Símbolos:
P = progenitores
g = gametos
F1 = primera generación filial F2 = segunda generación filial (F2) El carácter dominante se expresa con mayúsculas y el recesivo con minúsculas (ambas con la misma letra)
-Sintetizando un ejemplo de los trabajos de Mendel en los fenotipos observados
-Asignando los genotipos a los fenotipos correspondientes y descifrando el modelo
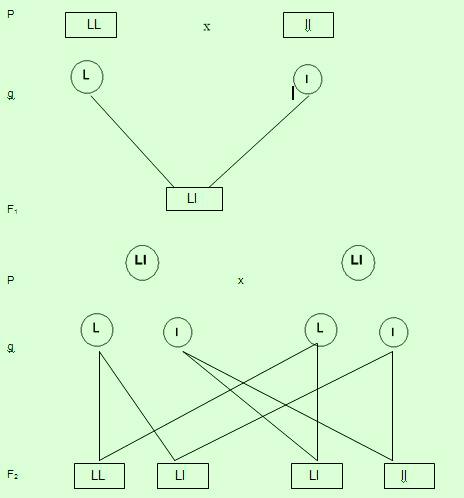
LL: Plantas con semillas lisas Ll: Plantas con semillas lisas ll: Plantas con semillas rugosas
- En los progenitores cada carácter viene dado por un par de alelos. En cada individuo el par es homocigoto ; en forma arbitraria se eligió la letra “ele”.
-El polen y el óvulo de cada planta aportan la mitad de la información genética en cada uno de los gametos.
-La primera generación resulta de la combinación de los caracteres constituyendo un monohíbrido, que va a autofecundarse para constituir la segunda generación.
-Cada gameto de cada progenitor porta la mitad de la información.
-En la segunda generación hay una mezcla al azar entre los dos factores; la proporción fenotípica es de 3 : 1 ó 3 lisas : 1 rugosa
-La proporción genotípica es 1 : 2 : 1 ó 1 LL; 2Ll; 1ll.
Actividad de aprendizaje:Los genes son unidades de información.
Segunda ley: Distribución Independiente.
Se cuenta una anécdota acerca del famoso dramaturgo inglés Bernard Shaw, que a su brillante ingenio e inteligencia se oponían su corta estatura y rasgos poco agraciados, mientras que otra famosa artista contemporánea se le atribuía una gran hermosura que contrastaba con su escasa inteligencia.
Un amigo del dramaturgo le hizo ver la posibilidad de tener hijos con la famosa artista y que estos obtendrían la belleza de la madre y la inteligencia del padre, a lo que Bernard Shaw inmediatamente contestó considerando la otra posibilidad: ¿Qué tal si sacaran la inteligencia de la madre y la belleza del padre?
La anécdota ilustra uno de los principios más importantes de la genética: “La segregación independiente de las características hereditarias”, aunque el fenómeno de la herencia de la belleza y de la inteligencia sean más complejos que en el anterior ejemplo, permite comprender que la belleza es un carácter que se hereda independientemente de la inteligencia y viceversa. Los genes son mezclados en la meiosis de tal forma que en el niño se expresan algunos caracteres que se encuentran en sólo uno de los progenitores. Es en esta forma como se producen nuevas combinaciones de características en la descendencia. Mendel comprendió que se efectuaba esa distribución y efectuó cruzamientos de chícharo para demostrarlo.
A continuación se presenta un ejemplo de los trabajos de Mendel para dos pares de caracteres en plantas que daban semillas lisas y de color amarillo con plantas de semillas rugosas y de color verde.

Los resultados mostraron a Mendel que había una recombinación de los factores implicados y de acuerdo con ello formuló el “Principio de la Segregación Independiente de los Caracteres”. Cada generación se comportó exactamente como en un cruzamiento monohíbrido.
Aproximadamente ¾ partes de la descendencia tuvieron plantas de semillas amarillas y ¼ verdes (416:140) y lo mismo aplica al carácter lisas y rugosas (423:133). En consecuencia estamos considerando 2 cruzamientos monohíbridos al mismo tiempo.
Hay 16 formas de combinar los 4 gametos masculinos diferentes producidos en la planta F1 con los cuatro tipos diferentes de gametos femeninos también originados en la planta F1. En esos gametos se observa cómo un par de alelos no solo “segregan independientemente” sino también se “recombinan” o “distribuyen” independientemente.
En seguida se ilustra la cruza de dos pares de caracteres. La descendencia en la F2 se presenta en un cuadro de Punnett.
F2 Segunda generación.
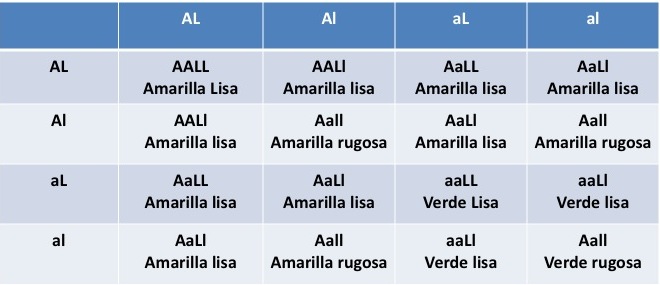
- 9 / 16 amarilla lisa 315
- 3 / 16 verde lisa 108
- 3 / 16 amarilla rugosa 110
- 1 / 16 verde rugosa 32
La segregación independiente de los caracteres ha sido reconocida como la primera ley de Mendel y la recombinación o distribución independiente de los caracteres, como la segunda. Si bien, explícitamente Mendel no enunció ley alguna, estas “leyes” o principios, son los fundamentos que constituyen al modelo de la mecánica de la herencia que permite comprender y prever el comportamiento del fenómeno de la herencia.
Segunda ley: Distribución independiente.
Los gametos, vehículos portadores de los genes realizan la distribución de estos mediante la meiosis. Las células pre-meióticas tienen dos cromosomas de cada clase, llamados cromosomas homólogos. En cada uno de estos cromosomas hay un gene o alelo para cada carácter ocupando el mismo locus (lugar) en los cromosomas homólogos.
En el siguiente diagrama se ejemplifica la distribución de los genes en un heterocigoto.
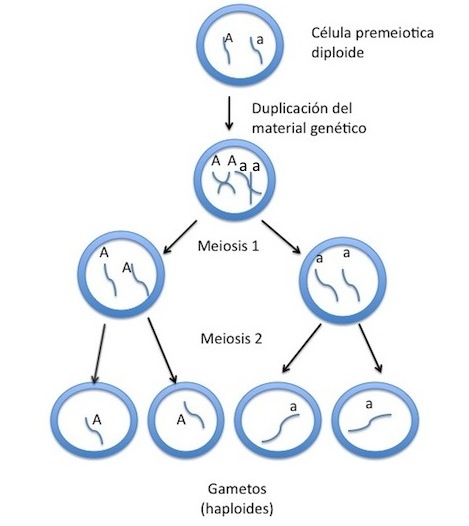
Como se aprecia en el ejemplo anterior, un par de genes diferentes (heterocigoto) se distribuyen en dos tipos distintos:
Cada gameto lleva sólo la mitad de información; esto es, un gene de cada par que se combina con cada uno de los miembros de los demás pares. Una forma de establecer las combinaciones es dicotomizando a cada par heterocigoto. A partir de cada par heterocigoto se producen dos nuevas combinaciones.
Método Dicotómico para obtención de gametos diferentes
- Para un par heterocigoto (monohíbrido)
AABbCC. Esta es una célula que contiene tres pares de genes. El segundo par es heterocigoto (Bb)
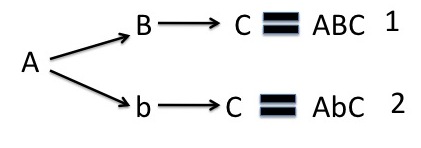
El par segundo que es un heterocigoto forma una dicotomía. Se obtuvieron dos gametos diferentes.
Para dos pares Heterocigotos (Dihíbrido) Aa Bb CC
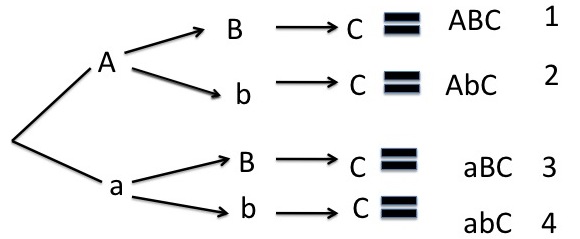
El primero (Aa) y segundo (Bb) par de genes de esta célula diploide son heterocigotos. El primero y segundo par se dicotomizan por ser heterocigotos. El tercer par no se dicotomiza por ser homocigoto. Se obtienen 4 gametos diferentes.
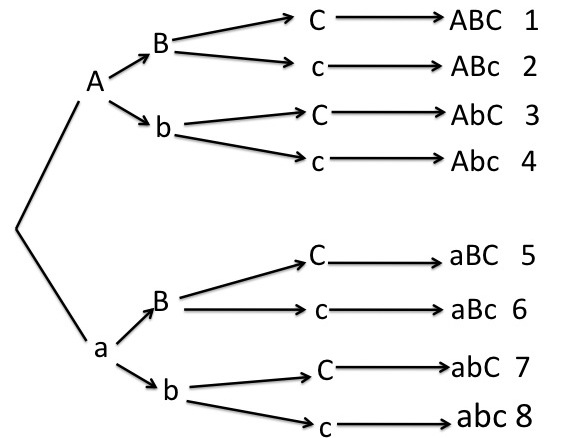
Para tres pares heterocigotos (Trihíbrido).
- Los tres pares son heterocigotos. Los tres se dicotomizan, se obtienen 8 gametos diferentes.
Método numérico para obtención de gametos diferentes
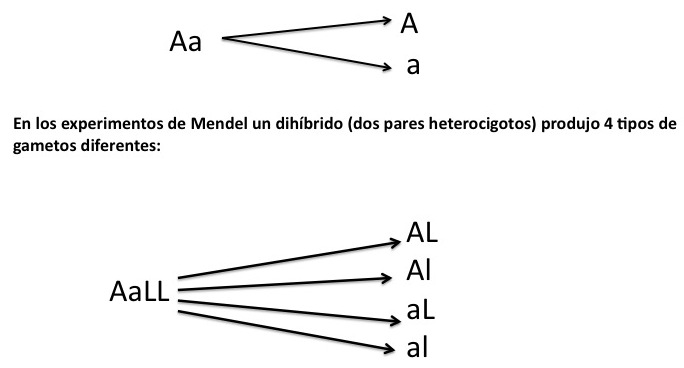
Seguramente habrás notado que el número de gametos diferentes que se obtienen depende del número de pares heterocigotos. Esta relación se expresa como:
2n = Número de gametos diferentes, donde “n” significa el número de pares heterocigotos.
Ej. Para un par heterocigoto
21 = 2 gametos diferentes
Ej. Para dos pares heterocigotos:
22 = 4 gametos diferentes
Ej. Para tres pares heterocigotos
23 = 8 gametos diferentes
Práctica: Identificación de algunos Factores de Genética Humana
Video Las Leyes de Mendel: Primera Ley
Video Las Leyes de Mendel: Segunda Ley
Video Las Leyes de Mendel: Tercera Ley
•Variantes de la herencia mendeliana.
Herencia ligada al sexo.
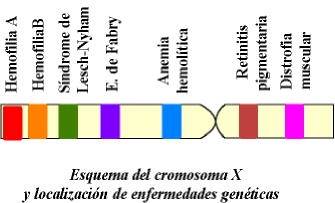
La herencia ligada al sexo se ocupa del estudio de aquellos genes que se encuentran ligados con el cromosoma “X” o con el cromosoma “Y”.
Genes ligados en el cromosoma “X” .- Entre estos genes están los que causan la hemofilia, la distrofia muscular, ceguera nocturna congénita, ceguera al color, atrofia del nervio óptico, ictiosis (una condición áspera y escamosa de la piel), hipogamaglobulinemia (incapacidad para producir en la sangre suficiente gammaglobulina con la consecuente deficiencia de anticuerpos contra las infecciones bacterianas), diabetes insípida y deficiencia de la enzima de la deshidrogenasa de la glucosa - 6 – fosfato, lo que ocasiona anemia al comer habas o sulfanilamida u otras drogas.
La hemofilia , o “enfermedad hemorrágica”, que por muchos años ha afectado a las familias reales de Europa, se caracteriza porque las personas que la padecen llegan a tener grandes hemorragias, aun con heridas pequeñas. El tiempo que tarda su sangre en coagular le lleva entre 30 minutos y muchas horas. Una persona normal lo hace entre 2 y 8 minutos.
Si un hombre afectado por la hemofilia alcanza la edad adulta y se casa, sus hijos serán sanos pero los nietos varones que procedan de sus hijas serán probablemente hemofílicos.
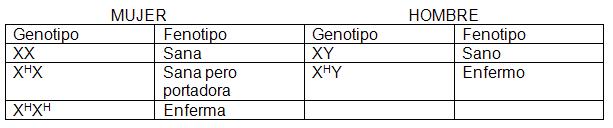
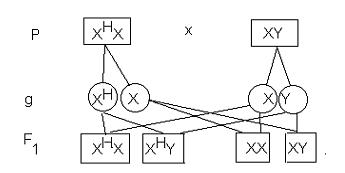
La explicación del comportamiento hereditario que se acaba de describir radica en que el gene de la hemofilia se encuentra en el cromosoma sexual X, el alelo correspondiente especifica la elaboración de una proteína del plasma que es necesaria para la coagulación de la sangre, ésta es la sustancia VIII, la globulina antihemofílica. Así pues, si una mujer presenta un gene de la hemofilia y otro para ser normal (que forma la globulina antihemofílica) se dice que es una mujer portadora, pero normal (XHX). La mujer es hemofílica sólo cuando en ambos cromosomas lleva el gene para la hemofilia (XHXH). Sin embargo en el varón es suficiente que lleve uno de los genes de la hemofilia (XHY) para que la enfermedad se exprese, ya que el cromosoma “Y” no lleva el alelo correspondiente. La probabilidad en la población de que un varón sea hemofílico es de una en 10, 000 y para una mujer es sólo de una en 100, 000, 000.
Por el patrón de herencia, se dice que la herencia ligada al sexo es dominante y recesiva en la mujer, ya que en esta última se requiere que estén presentes los dos alelos para que la enfermedad se exprese (XHXH) y en el hombre basta con un solo alelo (XHY). Esto se representa de la siguiente manera:
Ejemplo (1).- Una mujer normal cuyo padre era hemofílico se casa con un hombre normal, ¿Cuál es la probabilidad de que sus hijos sean hemofílicos?
Si el infante que nace es una niña tiene 100% de probabilidad de ser sana y si es niño, tiene 50% de probabilidad de ser hemofílico.
Ejemplo (2).- La distrofia muscular seudohipertrófica se expresa hasta después de los seis años de edad. Se caracteriza por un hinchamiento de los músculos que se continua por una demacración de los mismos y al llegar a los 12 años los niños son prácticamente solo piel y hueso. Generalmente mueren antes de llegar a la edad adulta, Si uno de estos individuos logra llegar a la edad adulta y se casa con una mujer sana ¿Cuál es la probabilidad de que sus hijos tengan distrofia muscular seudohipertrófica?
Todos los hijos mujeres y varones serán sanos sin embargo, las mujeres (portadoras), transmitirán posiblemente el gene de la distrofia muscular seudohipertrófica a la descendencia.
Codominancia.
Codominancia. Algunos rasgos hereditarios no presentan dos formas alternativas (dos alelos) o no necesariamente presentan una relación de dominancia y recesividad.
La codominancia se da cuando dos alelos en forma heteróciga se expresan ambos.
Ejemplo de codominancia. En el ganado vacuno y en los caballos el pelaje rojizo está determinado por el alelo CC y el blanco por el alelo CB y, si ambos alelos se presentan en un individuo (CC CB) el resultado es un toro o una vaca Roana, es decir de color blanco con manchas rojizas.

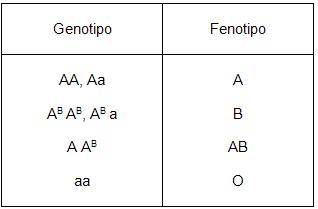
Y lo mismo sucede en los humanos con el tipo sanguíneo AB que es producto de dos alelos; el alelo IA y el alelo IB que cuando se encuentran ambos en un individuo (IA IB) forman el tipo sanguíneo AB, mientras que si se encuentra en forma homóciga (IA IA , o IB IB) determinan el tipo sanguíneo A o B según el caso. Favor de ver alelos múltiples.
Herencia intermedia.
Después del descubrimiento de los trabajos de Mendel se pensó que estos eran demasiado simples y hubo de hacerse nuevas interpretaciones. Tal es el caso de la herencia intermedia o dominancia incompleta. En este tipo de herencia los genes alelomórficos no implican una relación, como en los chícharos, de dominancia y recesividad. Ejemplo (1).- En la planta Mirabilis jalapa (o don diego de noche, o maravilla), la herencia del color de las flores sigue un patrón distinto. Si cruzamos plantas con flores rojas con otras de flores blancas, las plantas F1 tendrán flores rosadas. Si se cruzan dos de estas plantas obtendremos individuos con flores rojas ¼ ; flores rosadas ½ y flores blancas ¼ . De estos resultados es evidente que las plantas heterocigotas muestran la expresión parcial de ambos alelos. En este tipo de herencia los dos genes actúan, uno no inhibe la expresión o acción del otro. Cabe recalcar los principios mendelianos que explican este tipo de herencia: 1. La segregación que describe la separación de los alelos en forma de gametos puros. 2. La recombinación independiente de diferentes pares de alelos.
Actualmente se conocen varios caracteres en plantas y animales que siguen este tipo de herencia. Algunos de estos son:
Como en este tipo de herencia no hay dominancia y recesividad los símbolos para representarla no pueden ser letras mayúscula y minúscula. Para la herencia intermedia se utiliza una mayúscula básica para ambos y se añade un índice en la parte superior para distinguirlas o alguna letra. Ejemplo. Para representar el símbolo del color en el ganado Shorthorn se emplea la mayúscula C, si es de color rojo se coloca encima la “R” quedando como CR y si es blanco CB. De tal forma que el ruano o híbrido será CRCB.
Alelos Múltiples y Grupos Sanguíneos.
Hasta aquí los modelos de herencia que se han estudiado (Herencia Mendeliana y Herencia Intermedia) implican a un solo par de alelos, uno en cada cromosoma homólogo. Pero, puesto que un gene puede ser cambiado a formas alternativas por el proceso de mutación, teóricamente es posible un gran número de alelos en una población de individuos. Cuando más de dos alelos son identificados en el locus de un gen, se tiene una serie de alelos múltiples.
Por ejemplo, en la herencia de los grupos sanguíneos del sistema “ABO” intervienen tres alelos distintos. Cada uno de estos alelos ocupa un locus en el cromosoma homólogo, lo que significa que sólo un par de alelos actúan, pero este locus puede ser ocupado por tres alelos distintos.
Actualmente la mecánica de la herencia de los grupos sanguíneos merece un capítulo de estudio aparte.
Desde el siglo XVIII, se realizaban transfusiones de sangre. En Francia, a causa de las heridas de un duelo un hombre estaba muriendo y se salvó por una transfusión que se le hizo mediante la simple conexión con las venas de un donador. Otros que quisieron imitarlo tuvieron éxito, pero muchas otras veces ocasionaron la muerte del paciente porque los glóbulos rojos trasfundidos formaban aglomerados que obturaban los vasos capilares del paciente.
No fue sino hasta 1901 que se empezó a entender como reaccionan los grupos sanguíneos gracias a los trabajos de Karl Landsteiner. Lo que hizo fue separar las células del plasma correspondientes a 22 personas. Luego combinó el plasma de una persona con las células rojas de otra. En algunos casos la combinación fue satisfactoria, pero en otros los glóbulos rojos se aglomeraban (aglutinaban) en grupos tan grandes que podían verse a simple vista. Basándose en estas reacciones, Landsteiner dividió a los humanos en tres grupos: A, B y O. Poco después (1902), el cuarto y más raro grupo, el AB, fue descubierto por dos discípulos de Landsteiner, Von De Castello y Sturli.
Antígenos y anticuerpos
Los tipos de sangre se establecen de acuerdo a las interacciones entre antígenos y anticuerpos (serología).
Los antígenos o aglutinógenos forman parte de casi todas las proteínas y de algunos de los más complejos carbohidratos y ácidos nucleicos. Están asociados con las células rojas de la sangre. Los antígenos son sustancias capaces de producir anticuerpos.
Los anticuerpos o aglutininas son proteínas del plasma (Gammaglobulinas) producidas de manera principal por las células del plasma, que son una parte del sistema sanguíneo de los animales vertebrados superiores. Los anticuerpos son altamente específicos, sólo reaccionan con el [[Ir a Glosario #Antígeno.|antígeno] que estimuló su producción (o probablemente [[Ir a Glosario #Antígeno.|antígeno]s muy similares).
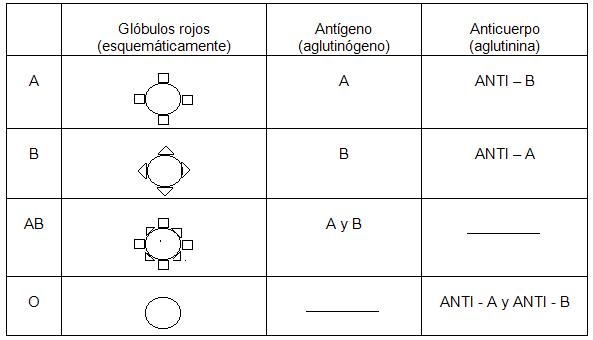
Las personas que pertenecen al grupo sanguíneo “A” tienen en sus glóbulos rojos la proteína que se designa como antígeno “A” (o aglutinógeno “A”) y en el suero posee anticuerpos “B” (ANTI – B).
Los que pertenecen al grupo sanguíneo “B” en los glóbulos rojos llevan el antígeno “B” y en el suero anticuerpos “A” (ANTI - A).
Los que pertenecen al grupo “AB” llevan en sus células rojas los antígenos “A” y “B” pero no poseen aglutininas (anticuerpos) en el plasma.
Se pueden concentrar los grupos sanguíneos en el siguiente cuadro:
Actualmente siempre que se trata de hacer una transfusión de sangre a una persona, se le suministra de su mismo tipo.
En el siguiente cuadro se presentan a los donadores y receptores compatibles en el sistema “ABO”
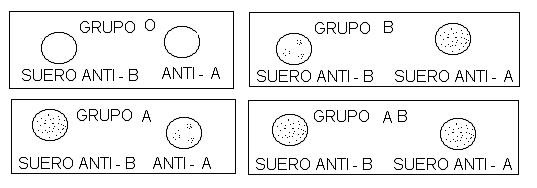
En el cuadro anterior te podrás dar cuenta que el grupo “O” puede donar sangre sin problemas de incompatibilidad a todos los grupos del sistema “ABO”. Esto se debe a que las células rojas del donador no llevan ningún antígeno, por lo que no produce en el receptor una respuesta para formar anticuerpos.
Una persona del grupo “A” no debe donar sangre a un individuo con grupo sanguíneo “B” porque ésta tiene anticuerpos “A” que aglutinan al grupo “A”.
El siguiente esquema representa la reacción debida a la mezcla de diferentes tipos de corpúsculos y sueros sanguíneos:
Herencia de los grupos ABO
Como se mencionó anteriormente, en la herencia de los grupos sanguíneos “ABO” intervienen tres alelos distintos: “A”, “B”, “a”.
Como se observa en el cuadro anterior, cuando el alelo A y el AB están presentes los dos se expresan y la persona tiene sangre del tipo AB. Por tanto los alelos son codominantes. Un tercer alelo de esta serie, “a” es recesivo con respecto al alelo A y al AB. Los homocigotos del alelo “a” tienen siempre el grupo sanguíneo “O”.
La mecánica de la herencia de los grupos sanguíneos que es bien conocida actualmente, tiene una aplicación médico legal. Se dice que el Rey Salomón nunca habría tenido necesidad de emplear su profunda sabiduría para decidir a quien dar la custodia de un infante si hubiera tenido a su disposición las técnicas modernas para el análisis de la sangre.
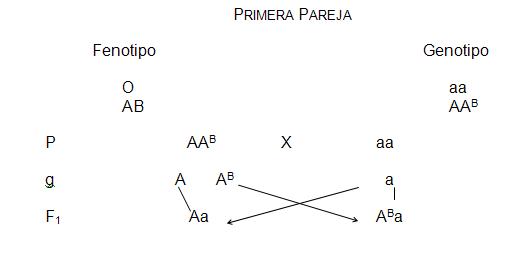
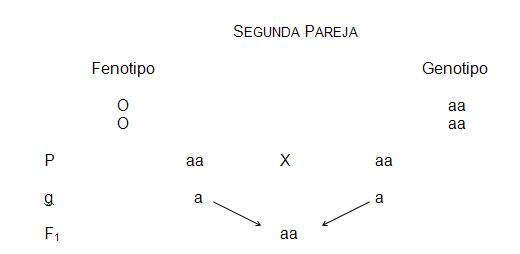
Ejemplo (1).- En un hospital nacieron dos niños el mismo día a la misma hora. Uno de los infantes era de tipo “O” y el otro era de tipo “A”. Por una confusión en el hospital no se sabe entre dos parejas quienes son sus padres. La primera de las parejas tiene grupos “O” y “AB” y en la segunda pareja ambos progenitores son “O”. ¿Cuál es el hijo que corresponde a cada pareja?
Los hijos que puede tener esta pareja pertenecen al grupo “A” o al “AB” pero no hay posibilidad de que tengan un hijo grupo “O”.
Todos los hijos que tenga esta pareja serán del grupo “O”, no hay posibilidad de que tengan hijos “A”.
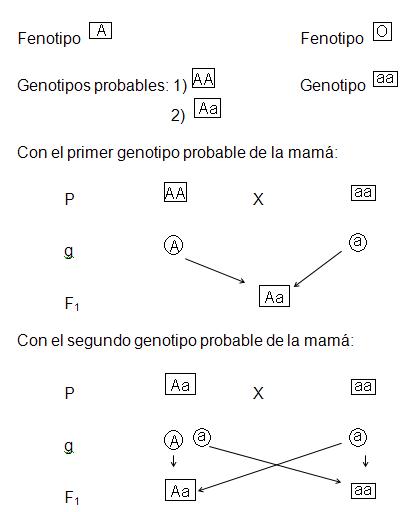
Ejemplo (2).- Una mujer con grupo sanguíneo “A”, tiene un hijo de grupo B y demanda a un individuo tipo “O” para que mantenga a su hijo pues aduce que él es su padre. Si tu fueras juez en este caso, ¿cuál sería tu decisión?
De ninguna manera existe alguna posibilidad que la pareja en cuestión pueda tener un hijo con tipo de sangre “B”. Por lo tanto, el demandado no es culpable.
El Factor Rh
El factor Rh fue descubierto en 1940 por Landsteiner y A. S. Wiener en conejos inmunizados por el mono Macacus rhesus. Los anticuerpos resultantes aglutinaron, no solamente a los corpúsculos rojos de la sangre de los monos, sino también, en alto porcentaje a los de la población caucásica de Nueva York. El símbolo “Rh” viene de las dos primeras letras del nombre científico de la especie del mono (rhesus).
Las personas que poseen el antígeno Rh se dice que son Rh positivos y las que carecen de dicho antígeno se les clasifica como Rh negativos.
Dos personas compatibles en el sistema ABO, pueden no serlo en el Rh. Mientras que los anticuerpos del sistema ABO se encuentran de forma natural en el plasma humano, los anticuerpos anti RH puede estimularse su formación en una persona Rh negativo si se hace transfusión con tipo de sangre Rh positivo. Sin embargo, en una primera transfusión no hay una respuesta inmediata por parte del receptor.
Una vez sensibilizado si recibe una transfusión del mismo tipo, los eritrocitos donadores Rh positivos se aglutinarán en el receptor y puede sobrevenir la muerte.
El mismo problema ocurre si la madre es Rh negativo y el infante Rh positivo. Si es el primer niño que va a nacer y la madre no había sido sensibilizada anteriormente por el antígeno Rh seguramente no tendrá problemas en su nacimiento. Pero los hijos que se engendren posteriormente con Rh positivo verán disminuidas sus posibilidades de un parto normal, pues ya la madre ha sido sensibilizada (inmunizada) con el factor Rh. Estos segundos niños tienen sus eritrocitos destruidos (hemolizados) antes del nacimiento y como resultado de ello se liberan eritrocitos (células rojas) inmaduros, los cuales todavía no han perdido sus núcleos. Las células rojas con núcleo no son buenas transportadoras del oxígeno y los infantes pueden sufrir anoxia (Falta de oxígeno en la sangre).
También los restos de muchos eritrocitos hemolizados tienden a obturar los ductos biliares y esto produce ictericia; algunas veces estos niños mueren antes de nacer o unos cuantos días después. Cuando sobreviven alrededor de una semana se dice que el peligro ha pasado, pues esto indica que ya están formando eritrocitos normales. A esta condición se le llamo “Eritroblastosis Fetilis” y en fechas más recientes se le conoce como “Enfermedad Hemolítica del Recién Nacido”.
Mientras que los problemas para madres Rh negativo e hijo Rh positivo se expresan generalmente hasta al fin del embarazo o hasta el nacimiento del infante, las diferencias entre la madre e hijo en el sistema ABO se manifiestan desde las 7 u 8 semanas del embarazo, cuando el embrión muere y es abortado debido a la concentración de los ANTI – A y ANTI – B que es ordinariamente mucho más elevada que los ANTI – Rh.
El antígeno Rh en la herencia
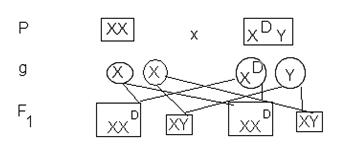
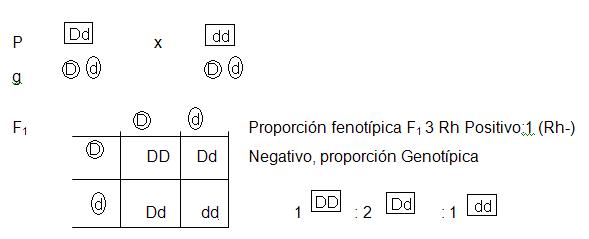
Como ya se mencionó, el problema de incompatibilidad en el Rh entre la madre y el hijo ocurre sólo cuando la madre es Rh negativo y el hijo es Rh positivo, situación que se presenta si el padre es Rh positivo, ya que el Rh negativo se presenta cuando el alelo recesivo (d) se encuentra en condición homociga. La herencia de este tipo de factor se comporta igual que la herencia mendeliana. Actúan un par de alelos y uno de ellos es dominante y el otro recesivo:
Ejemplo (1).- Si se casa un varón de tipo sanguíneo Rh positivo (cuyo padre es Rh negativo), con una mujer de Rh negativo, ¿cuál es la probabilidad de que tengan hijos con Rh positivo?
La probabilidad de tener hijos con Rh positivo es de 50%.
- Ejemplo (2).- Si se casa un varón Rh positivo (cuya madre es Rh negativo), con una mujer Rh positivo (cuyo padre es Rh negativo), ¿cómo será el Rh de los hijos?
Cada hijo tiene 75% de probabilidad de tener Rh positivo y 25% de probabilidad con Rh negativo.
Teoría Cromosómica de la Herencia
La herencia es un proceso biológico que siempre ha intrigado al hombre, pues desde antigüedad se sabía que los hijos heredan de los padres, e incluso de los abuelos, muchos rasgos físicos y de carácter. Fue hasta la segunda mitad del siglo XIX cuando un monje austriaco, Johann Gregor Mendel (1822-1884), descubrió los principios básicos de la herencia y fue el inicio de la genética como ciencia. Cuando Medel realizó sus experimentos, no se tenían conocimientos referentes a la existencia de la molécula del ADN y que esta se encontraba en los cromosomas. Sus trabajos fueron publicados en 1865 pero desafortunadamente, no se les dio la importancia que merecían y permanecieron ignorados durante mucho tiempo. En 1900, el holandés Hugo De Vries, el alemán Carl Correns y el austríaco Eric Von Tschermak, sin conocer los trabajos de Mendel llegaron a las mismas conclusiones que él. Al redescubrir las publicaciones previas de Mendel reconocieron su prioridad y publicaron sus conclusiones como meras confirmaciones.
Sutton y Boveri. También por separado, propusieron que los factores hereditarios (genes) se encontraban en los cromosoma. Los cromosomas se encuentran en pares en un individuo, cada uno heredado de un progenitor (cromosomas homólogos). Durante la meiosis se separan y cada uno va a un gameto, tal y como lo propuso Mendel. Esta teoría enlazaba la citología con la genética. También se observó que existían cromosomas homólogos, parejas de cromosomas idénticos o autosomas, y una pareja de cromosomas distintos denominados heterocromosomas o cromosomas sexuales (X y Y).
Gracias al redescubrimiento de los trabajos de Mendel y su aplicabilidad para tratar problemas de la herencia se comienza a desarrollar la genética moderna.
En 1909, Johannsen, botánico danés designó “al factor hereditario” de Mendel con el término gene, así como introdujo los términos de genotipo y fenotipo. En 1910, Thomas Hunt Morgan, observó en sus experimentos con la mosca del vinagre que los machos de esta especie tenían tres pares de cromosomas homólogos, llamados autosomas, y un par de cromosomas parecidos, pero no idénticos, a los que designó con las letras X y Y y los denominó heterocromosomas o cromosomas sexuales, ya que son los responsables del sexo. Más tarde, Morgan descubrió que algunos caracteres hereditarios se transmiten juntos, como por ejemplo, el color del cuerpo de la mosca Drosophyla melanogaster, el color de los ojos, el tamaño de las alas, etc. Después de efectuar numerosos cruces comprobó que había cuatro grupos de genes que se heredaban ligados. El ligamiento hace que dos caracteres sean transmitidos juntos, mientras que el entrecruzamiento o recombinación significa que pueden ser separados durante generaciones posteriores. Un caso de ligamiento es lo que se conoce como herencia ligada al sexo y fue descubierta por Morgan.
En 1915 Morgan y sus estudiantes, Alfred Henry Sturtevant, Herman Joseph Muller y Calvin Blackman Bridges llegaron a las siguientes conclusiones: Que los factores elementales de los que Mendel hablaba eran los genes y que formaban parte de los cromosomas (bastoncillos localizados en el núcleo) de las células y que por lo tanto, los genes podían ser tratados como puntos específicos dentro de ellos y. así saber su localización dentro de ellos. A esta teoría se le conoce como la Teoría Cromosómica de la herencia. También afirmó que los cromosomas conservan la información genética y la transmiten de generación.
Después del establecimiento de la teoría cromosómica de la herencia se estableció la idea de que ciertos factores externos, como las radiaciones pueden producir efectos sobre los cromosomas. Esta idea desarrollada por Muller, estableció que los genes tienen una existencia física capaz de cambiar o alterarse o sea, mutar por efecto de agentes externos, y que su característica más importante es el que estas variaciones sean heredables. De esta forma quedó establecido que la forma en la cual aparece la variación en la evolución es a través de mutaciones o cambios físicos de los genes.
•Mutación y cambio genético.
Mutación. Desde el punto de vista de la semántica, el origen de la palabra es latino y viene de mutatus que significa cambio, más la terminación ión, que es el resultado de un proceso o acto. En biología la mutación es un cambio heredable en el ADN, que puede alterar la expresión de un gene. Generalmente las mutaciones son fuente de las diferentes versiones de los genes (alelos) y por lo tanto de la diversidad de la vida. El resultado de la mutación puede ser neutral, benéfico, perjudicial o letal, dependiendo de cómo altere la función del gen bajo ciertas condiciones prevalecientes en un ambiente determinado.
En la naturaleza, la mutación es un evento relativamente raro, y es impredecible saber cuándo, y en que individuos aparecerá. Inclusive cada gene tiene su propia tasa de mutación, la cual se puede definir como: la probabilidad de que un determinado gene mute durante la replicación del ADN, o entre una replicación y otra. Se calcula en general que la tasa de mutación para un gene promedio es de uno en un millón (106) de replicaciones.
Se sabe que los genes mutan en forma independiente unos de otros. Así, para predecir la probabilidad de mutación de 2 genes cualesquiera, se deben de multiplicar las tasas de mutación individuales de cada gen entre sí. Por ejemplo; si el gen A presenta una tasa de mutación de 1 en un millón (106) y el gen B de una en mil millones (109), entonces la probabilidad de que muten estos dos genes al mismo tiempo dentro de una misma célula es de (1015) o sea una en mil billones.
Como ocurren miles de millones de replicaciones durante el crecimiento y desarrollo en humanos por ejemplo, existe la posibilidad de que alguna o algunas células contengan una mutación, y si esta mutación se efectúa en una célula reproductora (gameto), la mutación puede ser transferida a los descendientes. Ahora bien, ¿cuál puede ser el resultado de la mutación en el fenotipo de un individuo? Esto dependerá de cómo afecte la mutación a la síntesis de proteínas.
Algunas mutaciones son dañinas. Cada individuo de una especie es una combinación de genes que se han seleccionado a lo largo de generaciones sucesivas y probado en cierto rango de condiciones ambientales. Una mutación con efectos drásticos sobre la información genética, puede reducir o anular la reproductividad o la posibilidad de supervivencia del individuo. Tales mutaciones se les conoce como letales, y obviamente no se transmite a las siguientes generaciones, pero otras mutaciones tienen un efecto menos severo, y estas son llamadas mutaciones neutras, que no son benéficas o perjudiciales para quienes las poseen, pero se acumulan en la información genética. Este tipo de mutaciones pueden tener algún efecto sobre la tasa de reproducción o supervivencia a futuro, cuando las condiciones ambientales cambien, y entonces puedan dar una cierta ventaja adaptativa o reproductiva a quienes la posean.
La selección natural juega un papel importante en la perpetuación de ciertos genes (genes benéficos), pero también son importantes los mecanismos que los protegen. Por ejemplo: las ventajas adaptativas que tienen las células que presentan genes que forman enzimas reparadoras de los errores de apareamiento de bases nitrogenadas. Tales enzimas ayudan a proteger la estabilidad del ADN que tiene que replicarse, y que de hecho se ha replicado innumerables veces desde que aparecieron los primeros seres vivos.
La selección natural ha actuado sobre las mutaciones a lo largo de la historia de la vida, de manera tal, que ha permitido la evolución y diversificación de los seres vivos, solo tenemos que recordar que todos los seres vivos poseen la misma herencia química. El humano esta constituido de la misma estructura química, usando las mismas bases nitrogenadas que la ballena azul, el ratón domestico, el huitlacoche o el gusano de maguey por ejemplo. Nuestro ADN se replica de la misma manera que en ellos, y usamos el mismo código genético para la formación de las proteínas. Desde el punto de vista evolutivo, la única razón por la cual somos humanos, la ballena un cetáceo, o por la que cada ser vivo pertenece a una determinada especie, es que la selección natural ha actuado sobre diferentes tipos de mutaciones que han dado origen a diferentes líneas de descendencia, así la secuencia en los pares de bases nitrogenadas determinan las características diferentes entre especies, de los cuales se desprenden tres conceptos fundamentales: Primero: el ADN es la fuente original de la información hereditaria de todos los seres vivos. Segundo: la mutación es la fuente primaria de la diversidad, y tercero: el ambiente y sus cambios son el campo de prueba de los genes nuevos que aparecen por mutación.
Mutación y síntesis de proteínas. Los cambios del ADN producto de la mutación, afectaran también a la síntesis de proteínas en la célula, que es un proceso dirigido directamente por la secuencia de bases nitrogenadas en cada gene.
Para que se sintetice una determinada proteína, se requiere de una secuencia especifica de bases nitrogenadas del ADN, que indiquen en que secuencia deben unirse los aminoácidos, esta secuencia será única para dicha proteína. Si surge un cambio en el orden o en el número de las bases nitrogenadas, podemos esperar también, un posible cambio en la estructura de la proteína formada. Si el cambio en la estructura de la proteína afecta drásticamente el metabolismo celular, el resultado puede ser perjudicial e inclusive causar la muerte. En muchas ocasiones los genes se ven alterados, y el cambio puede ser la sustitución de una base nitrogenada por otra en la secuencia del ADN, o quizás pueda insertarse una base extra o incluso perderse. A estos pequeños cambios en la secuencia de nucleótidos del ADN, se les conoce como mutaciones génicas o puntiformes.
Algunas de estas mutaciones son el resultado de la exposición a agentes mutágenos, que son agentes que incrementan el riesgo de alteraciones en el ADN. Algunos de estos agentes son: la radiación como; rayos ultravioleta, radiación ionizante, o la presencia de agentes químicos o radicales libres. Pero aun en ausencia de agentes mutágenos puede haber mutaciones espontáneas durante la replicación, por ejemplo: la [[Ir a Glosario #adenina. puede erróneamente aparearse frente a una citosina, este error puede ser detectado por enzimas de reparación y corregir el error. Estas enzimas de reparación identifican el error, cortan el nucleótido incorrecto y lo reemplazan por un nucleótido que tenga la base complementaria correcta, pero en algunas ocasiones, las enzimas reemplazan el nucleótido correcto en lugar del incorrecto y esto produce una mutación.
En algunas ocasiones la mutación no modifica a la proteína, por ejemplo: el triplete CTC codifica para el aminoácido ácido glutámico, pero si se modifica el triplete quedando CTT, el triplete mutante también codifica para el mismo aminoácido y, por lo tanto, no hay cambio en la proteína que se formará. Sin embargo, en secuencias de ARN, si se tiene un triplete AUU, que codifica para el aminoácido isoleucina y la mutación cambia el uracilo de en medio por una citosina (ACU), ahora, este triplete codifica para el aminoácido treonina, y en la proteína aparecerá el cambio. Las inserciones o supresiones de bases nitrogenadas pueden afectar drásticamente a un gene, porque todos los tripletes después de la inserción o supresión serán mal leídos y la proteína no será funcional. Otra posibilidad es que la mutación produzca un codón que indique la terminación de la cadena de aminoácidos y se corte la cadena antes de que se termine de formar la proteína y esto puede afectar gravemente la función de la proteína o hacerla no funcional.
•Manipulación del DNA.
DNA y biotecnología.
El término biotecnología se refiere a la aplicación de la tecnología (Conjunto de teorías y de técnicas que permiten el aprovechamiento práctico del conocimiento científico) en los sistemas vivos y/o sus derivados para la obtención de productos de valor, o un servicio útil para el humano. La biotecnología implica el uso de conocimientos extraídos de diferentes campos del conocimiento como: genética, química, ingeniería, medicina y bioquímica, entre otros.
De acuerdo a lo anterior, la biotecnología a sido utilizada por los humanos desde los inicios de la civilización, uno de los primeros fue el cultivo de plantas para la producción de alimentos, así como de la selección de cultivos más apropiados a diversos suelos y climas, seguida de la cría y selección de animales en la ganadería. Con el tiempo y con los nuevos conocimientos adquiridos se incrementó la producción agrícola mediante la rotación de cultivos en diversas partes del mundo, por ejemplo; sin saberlo, pero con base en la experiencia se incrementaban la producción agrícola usando los microorganismos del suelo en el México prehispánico, ya que se sembraba el maíz y frijol intercalados en un solo cultivo, y las bacterias simbióticas del frijol fijaban el nitrógeno indispensable para el crecimiento de las plantas. También, mediante el uso de microorganismos se elaboró pan, yogurt, queso y bebidas alcohólicas como cerveza y vino y se utilizaron algunas plantas en el tratamiento de enfermedades.
En la actualidad, para muchas personas, la biotecnología se refiere a los nuevos campos de investigación y de conocimiento, conocidos en su conjunto como ingeniería genética, que incluye a la tecnología del DNA recombinante, secuenciación del DNA, la terapia génica, clonación y el proyecto genoma humano y sus implicaciones éticas.
La biotecnología se ha utilizado con fines prácticos, pero en muchas ocasiones estas aplicaciones conllevan conflictos de opinión. Un ejemplo sencillo es cuando se usan microorganismos para la producción de bebidas alcohólicas por fermentación. La fermentación alcohólica al parecer fue descubierta por los egipcios, aunque desconocían que el proceso lo llevaban a cabo las levaduras, las cuales fueron descubiertas a mediados del siglo XIX. Para algunas personas la producción de bebidas alcohólicas representa una ganancia económica importante, para otras, una forma de recreación y de obtención de placer, pero para otras puede significar romper una regla religiosa o ver la producción de bebidas alcohólicas y su consumo como potenciales causas de deterioro económico del individuo o de su salud, así, la utilización de las levaduras para la fermentación alcohólica se puede ver desde diferentes puntos de vista. Esto mismo sucede con muchas aplicaciones de la biotecnología. Se encuentran en conflicto de opinión, por lo que será necesario evaluar cada avance y aplicación por separado y analizar sus posibles beneficios y daños.
En la antigüedad no sólo se utilizaron los microorganismos para la elaboración de bebidas alcohólicas y hacer pan, pues también se utilizaron para la conservación de alimentos antes de la invención de los refrigeradores, así el yogurt, los quesos, la salsa de soya y el vinagre (todos ellos productos de fermentación) permitieron conservar por más tiempo a los alimentos así procesados, en comparación a los alimentos sin procesar. Incluso los microorganismos permitieron dar mejor sabor, olor y textura a la comida sometida a estos procedimientos, por ejemplo; El queso Rochefort adquiere su sabor debido a la presencia de los hongos Penicillium roqueforti y los hoyos en los quesos como el gruyere se deben al CO2 producido por la bacteria Propionibacterium que transforma a la leche en queso. También el chocolate depende de un proceso microbiano para su elaboración (fermentación).
En la actualidad, la mayoría de las personas cuando piensan en biotecnología, lo más probable es que tengan en mente la tecnología del DNA recombinante, aunque mucho de la moderna tecnología no tiene nada que ver con el manejo del DNA. La biotecnología clásica comenzó mucho antes de que se descubrieran los cromosomas y genes, con las técnicas para la producción de más alimentos en agricultura, ganadería y las técnicas farmacéuticas.
La moderna biotecnología comenzó entre finales del siglo XIX y principios del XX. Por aquel entonces, los trabajos de Mendel en genética en genética se redescubrieron y se dieron a conocer muchos y diferentes microorganismos fermentadores y la industria y la agricultura comenzaron a incorporar la biotecnología a la producción. Por ejemplo; La industria del automóvil uso la fermentación para la producción de acetona y solventes para pintura, pero ya para la mitad del siglo XX los avances en genética dominaron la investigación científica, destacando entre ellos, el descubrimiento de que el DNA contenía la información genética, la estructura de doble hélice del DNA y el código genético, descubrimientos que pronto desarrollaron la posibilidad de manipular el DNA.
La estructura, función y composición del DNA es virtualmente idéntica en todos los sistemas vivos, ya sean microorganismos, plantas, hongos o animales, sin embargo, cada organismo es diferente a los demás (excepto en gemelos). Lo que hace a cada organismo diferente, es el orden en la secuencia de las bases nitrogenadas contenida en su molécula de DNA. Esto les dio a los científicos la posibilidad de cambiar el orden de las bases y así modificar la información de algunos organismos en particular con fines específicos (económicos principalmente y de salud; que también son económicos), así, se asociaron los científicos con los industriales buscando alterar genéticamente a algunos organismos, transfiriendo genes de unos organismos a otros.
En la actualidad se modifican (alteran) los organismos a nivel molecular y, desde que la compañía norteamericana Genetech desarrolló la tecnología para re-arreglar el DNA a mediados de la década de los 70´s del siglo pasado, otras compañías han surgido con los mismos propósitos comerciales y se ha desarrollado la tecnología para la producción de interferón, insulina y vacunas entre otros, se han desarrollado animales transgénicos, como los ratones que genéticamente desarrollan cáncer diez meses después de nacidos, para poderlos utilizar en la experimentación y el desarrollar de tratamientos farmacéuticos. Estas compañías biotecnológicas han sido alentadas a partir de 1980 por la legislación que hizo la suprema corte en Estados Unidos, que permite patentar microorganismos genéticamente modificados. Esto significa que virtualmente cualquier forma de vida en el planeta puede teóricamente convertirse en propiedad privada de una compañía o de una persona que la “creo”. Por lo que una de las grandes amenazas de la nueva biotecnología es la posibilidad de que los derechos sobre algunos seres vivos puedan convertirse en un monopolio de las grandes compañías.
Uno de los avances biotecnológicos más importantes es el Proyecto Internacional Genoma Humano, instituido por el departamento de energía de Estados Unidos y el Instituto Nacional de salud “National Institute of Health” para mapear el genoma humano con la esperanza de que este conocimiento ayudara a prevenir y tratar muchas de las enfermedades resultantes de la información genética que posean los individuos. Las implicaciones éticas de los nuevos descubrimientos biotecnológicos y en especial del Proyecto Genoma Humano, llevó a que James Watson (codescubridor de la estructura del DNA) fuera electo (principalmente por su calidad científica e importancia como formador de opinión en asuntos genéticos) como el primer director de la oficina del “Human Genome Research” del National Institute of Health y con gran percepción sugirió que una parte del presupuesto asignado al Proyecto Genoma Humano fuera destinado para estudiar las implicaciones, éticas y legales de los nuevos descubrimientos.
Como los nuevos descubrimientos progresan aceleradamente, la importancia de la regulación sobre cómo dichos conocimientos pueden ser usados, se ha convertido en un tema de primera importancia y, ahora los filósofos estudiosos de la ética, trabajan junto con los científicos y abogados para determinar, no sólo que se puede hacer, sino que debemos hacer con el conocimiento genético. En la actualidad, la biotecnología es usada para muchos propósitos en agricultura, en biorremediación y en medicina forense, en la industria y medicina se utiliza la técnica del PCR (Reacción en cadena de la polimerasa) y del DNA recombinante de manera rutinaria. Por tales motivos, la manipulación genética ha sido la principal razón de que la biología sea vista como la ciencia del futuro y la biotecnología como la líder en la industria.
Breve historia de la biotecnología:
• (500 a. de C.) En China se utiliza por primera vez como antibiótico el suero obtenido del moho de la soya para tratar la fiebre.
• (100 d. de C.) Se produce en china el primer insecticida de polvo de crisantemo.
• (1761) Edward Jenner inicia la inoculación para prevenir la viruela, “vacuna” a un niño con el virus de la viruela de vaca.
• (1870) Los cultivadores de algodón y maíz, desarrollan por hibridación muchas variedades con mejor calidad.
• (1911) El patólogo Peyton Rous descubre el primer virus causante de cáncer.
• (1928) El escocés Alexander Fleming descubre la penicilina.
• (1933) Se comercializan los primeros híbridos de maíz.
• (1942) Se produce industrialmente la penicilina.
• (1950) Se crea el primer antibiótico sintético.
• (1951) Se hace la primera inseminación artificial en ganado usando semen congelado.
• (1958) Por primera vez se fabrica DNA artificialmente.
• (1978) Se fabrica insulina por recombinación genética.
• (1979) Se sintetiza la hormona del crecimiento humana.
• (1980) Se erradica la viruela humana en todo el planeta y la suprema corte de USA. da la primera patente a la compañía Exxon para un microorganismo que digiere petróleo.
• (1981) Científicos de la Universidad de Ohio producen el primer animal (ratón) transgénico.
• (1982) Se fabrica la primera vacuna para ganado mediante DNA recombinado y se produce insulina humana mediante bacterias genéticamente modificadas.
• (1985) Se encuentran los marcadores genético de la fibrosis quística y de algunas enfermedades del hígado.
• (1986) Se aprueba la vacuna (producida por recombinación genética) para la hepatitis B humana. El interferón es el primer anticancerígeno producido por biotecnología.
• (1988) Se produce el primer maíz Bt. resistente a plagas.
• (1990) Tiene éxito la primera terapia génica en una niña de cuatro años que sufría de un desorden inmune.
• (1992) Se aprueba la somatotropina obtenida biotecnológicamente para incrementar la producción de leche en vacas.
• (1993) Se aprueba el uso de Betaseron, medicamento que se usa en el tratamiento de la esclerosis.
• (1994) Se certifica la erradicación de la polio por la “Commission for the Certification of Polio Eradication”. Se descubre el primer gene productor de cáncer.
• (1995) Se producen anticuerpos anticancerígenos.
• (1996) Se descubre un gene asociado con la enfermedad de Parkinson.
• (1997) Se clona a la primera oveja “Dolly” en Escocia.
• (1998) Se aprueba Herceptin, droga anticancerígena para pacientes que sobre-expresan el receptor HER2
• (1999) Una prueba de diagnóstico permite identificar la encefalopatía en bovinos, enfermedad llamada de las “vacas locas”.
• (2000) Se producen papas biotecnologicamente resistentes a virus.
• (2001) Se aprueba la primera droga contra la leucemia mieloide.
• (2002) Se aprueba el primer maíz transgénico resistente al gusano que ataca la raíz. Se clona el banteg, bovino parecido a la vaca que se encontraba en peligro de extinción.
• (2003) Se completa el Proyecto Genoma Humano.
• (2004) La Organización de las Naciones Unidas para la Alimentación y la Agricultura, apoya los cultivos que usan la biotecnología, como complemento a los cultivos tradicionales para ayudar a los productores pobres.
• (2005) Se autoriza e incentiva el uso de bioetanol como combustible para vehículos.
• (2006) Se autoriza el uso de Gardasil, la primera vacuna contra el virus del papiloma humano. Se aprueba la primera planta modificada para la producción de vacunas.
• (2007) Se aprueba la primera vacuna contra el virus H5N1 de la influenza aviar.
• (2008) Se aprueba el uso del primer animal genéticamente modificado para la producción de antitrombina humana, enzima que desactiva varias enzimas de la coagulación.
• (2009) Se secuencia el primer genoma bovino de una vaca Hereford y se clona al primer camello.
• (2010) En estados Unidos se crea la primera célula controlada por un genoma sintético.
• (2011) Se secuencia el genoma de la papa, cultivo de importancia mundial.
• (2012) Se descifra el genoma del gorila, cerdo y jabalí.
• (2013) Se secuencian los genomas del garbanzo y kiwi entre otros, científicos chinos y estadounidenses descubren la estructura molecular de uno de los principales receptores del VIH en humanos, lo que representa una mejora en el tratamiento de la enfermedad.
• (2014) Se crea el primer cromosoma sintético de levadura y científicos de 26 países completaron un proyecto de ocho años para realizar un mapa íntegro del genoma de la oveja.
Tecnología del DNA recombinante
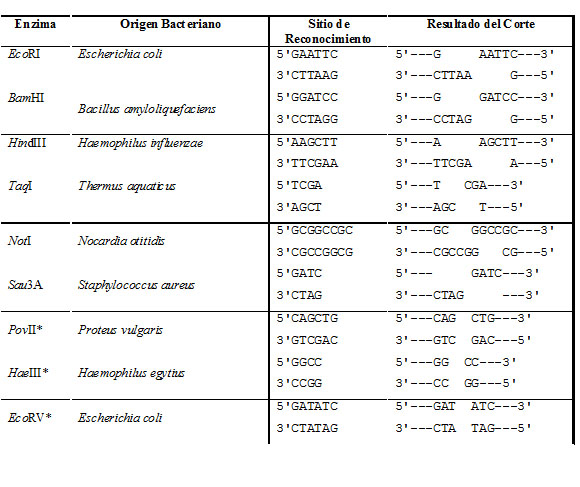
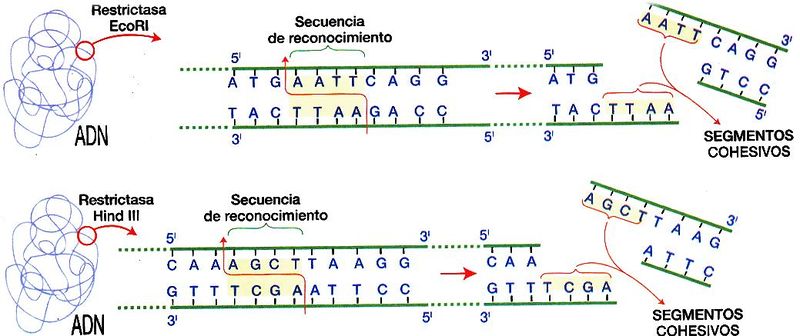
Hasta este punto, el Hombre conocía los mecanismos del control genético, pero no podíamos manipularlo. Un descubrimiento clave inició el cambio espectacular conocido hoy como Ingeniería Genética o ADN recombinante: En 1970 Arber, Smith y Nathans, en sus estudios sobre los virus bacteriófagos (también conocidos como fagos), descubrieron una enzima capaz de reconocer y cortar el ADN en secuencias específicas, identificaron una enzima que reconoció un sitio específico, es decir, una sucesión dada de bases nitrogenadas, se pegó ahí al ADN y la cadena se rompió.
De este modo, se llegó a un descubrimiento que permitió la digestión del ADN en fragmentos más pequeños y manejables, éste fue la identificación de enzimas bacterianas (Fig. 1) que reconocen secuencias de nucleótidos específicos y cortan el ADN cuando encuentran la secuencia de bases nitrogenadas adecuada.
Muchos microorganismos producen enzimas que modifican y digieren o rompen el ADN. Estos sistemas llamados de modificación-restricción, son análogos a un sistema inmune, los cuales probablemente evolucionaron como un mecanismo de protección de los microorganismos contra infecciones virales. En consecuencia, las bacterias, por ejemplo, son infectadas por virus, llamados bacteriófagos, que inyectan su propio ADN a la célula bacteriana para después controlar su maquinaria celular y redirigirla hacia la síntesis de sus propios componentes, dando como resultado final la ruptura de la célula y la liberación de cientos o miles de nuevos virus.(Fig. 2)
- Figura 2.
Así, como una manera de protección contra los virus, algunas bacterias modifican su propio ADN en ciertas secuencias. Para ello, una enzima de modificación se desliza sobre la hebra de ADN, y cada vez que se topa con su secuencia blanco, por ejemplo GAATTC, introduce un pequeño grupo metil (-CH3) en la [[Ir a Glosario #adenina.|adenina]] (A) central (ver imagen 3.). Otra enzima, la enzima de restricción, también se desliza en la hebra del ADN en esa posición. La enzima de restricción es capaz de cortar cualquier secuencia blanco que carezca de la marca química dejada por la primer enzima. De este modo detecta ADN extraño (de bacteriófago, por ejemplo), que pudiera dañar a la bacteria.

Hoy en día conocemos miles de diferentes enzimas de restricción, provenientes de otros tantos microorganismos distintos. Más de cien distintas secuencias pequeñas de ADN pueden ser rotas, específicamente por medio del uso de la enzima de restricción adecuada. Otra interesante propiedad de las enzimas de restricción es que, en general, reconocen secuencias palindrómicas, es decir, secuencias que son iguales si se leen en una dirección, o en la dirección contraria. Por ejemplo:
--5’GAATTC3’--
--3’CTTAAG5'—
es una secuencia palindrómica. Cuando actúa la enzima llamada EcoRI, que reconoce y corta esta secuencia, genera segmentos de ADN con extremos que se proyectan fuera de la doble cadena:
-- 5’G Rompimiento AATTC3’--
-- 3’CTTAA Rompimiento G5’--
Estos extremos se denominan cohesivos o pegajosos, por que tienden a aparearse o hibridarse nuevamente; en cotraparte a los cortes romos, que cortan al ADN entre los mismos pares de bases. En realidad, cualquier extremo del ADN generado por un corte con EcoRI puede hibridarse o aparearse con otro extremo generado por la misma enzima.
Así, podemos decir que una enzima de restricción es aquélla que es capaz de reconocer una secuencia especifica de nucleótidos del ADN y cortarla en sitios específicos. Debido al número de enzimas de restricción descubiertas, se ha desarrollado una nomenclatura específica para estos agentes biológicos. Dicha nomenclatura emplea diversa información, como el nombre de la especie de donde se obtuvo entre otros:
Por ejemplo, el nombre de la enzima de restricción EcoRI se obtendría de la siguiente manera:
Asimismo, las enzimas HaeII y HaeIII provienen de Haemophilus aegyptus, mientras que MboI y MboII de Moraxella bovis.
- TABLA CON ALGUNAS ENZIMAS DE RESTRICCIÒN Y LA MANERA EN QUE CORTAN AL ADN
Los descubridores de las primeras enzimas de restricción se dieron cuenta de que su acción sobre el ADN (comúnmente llamada "digestión") producía un conjunto definido de diferentes segmentos. Esto es particularmente fácil de detectar si la digestión se efectúa sobre una molécula pequeña; por ejemplo, ciertos virus están constituidos por genomas muy pequeños. El virus SV40 contiene una molécula de ADN circular de unos 5000 pares de bases. Muchas bacterias portan pequeñas moléculas de ADN, llamadas plásmidos, que llevan información accesoria a su cromosoma. Estas moléculas pueden tener también solo unos miles de nucleótidos. Si se somete el producto de digestión de una de estas moléculas a una separación por electroforesis, después de utilizar la enzima de restricción, se observa un patrón de bandas, que corresponde a los fragmentos de ADN de tamaños correspondientes a la distancia entre un sitio y otro. (Fig. 4)
Presentación: Tecnología del DNA recombinante
Clonación.
Entendemos como clonación al hecho de crear individuos genéticamente idénticos a partir de un original. El primer caso exitoso de clonación en animales, se realizó en 1952 a partir de un óvulo fecundado de rana. La técnica consistió en eliminar el núcleo del óvulo fecundado e insertar el núcleo de un embrión de otra rana. Esta técnica es relativamente sencilla, pues los huevos de Rana pipiens miden 2 mm. Además, solo requiere de técnicas de micromanipulación: con una micropipeta, se elimina el núcleo del óvulo receptor; con la misma, se extrae el de la célula donante y se espera a que el huevo se desarrolle hasta juvenil (renacuajo) y hasta adulto (rana).
De 1952 a la fecha, se ha avanzado mucho en técnicas y hasta la actualidad se han clonado unas 23 especies animales, entre los que se incluyen insectos, anfibios, peces y principalmente mamíferos. De entre ellos, tenemos a uno taxonómicamente cercano a los humanos, que es el mono rhesus (Macaca mulatta).
Quizá el caso más célebre hasta ahora sea el de la borrega Dolly (1996 – 2003), nacida a partir de una clonación realizada en el Insituto Roslin en Escocia. Dolly fue el primer mamífero transgénico clonado. La técnica empleada fue la de transferencia de núcleo, muy semejante a la mencionada en el caso de la rana, pero con modificaciones muy avanzadas.

Para algunos, las técnicas de clonación deberían culminar con la aplicación en humanos; no obstante, esto implica importantes problemas éticos. Incluso existe una prohibición internacional para la clonación humana.
Concepto de gen y genoma.
La idea de gen, aunque no significara siempre lo mismo, a servido de hilo conductor de la historia de la biología moderna. En el siglo XIX, Gregorio Mendel demostraba que los rasgos característicos de los organismos estaban determinados por unos “factores” hereditarios, presentes en las células germinales. El biólogo danés Wilhelm Johannsen llamó genes ha esos factores. A principios del siglo XX los genes se definieron como elementos discretos dispuestos de forma lineal en los cromosomas.
El concepto actual de gen es considerado como la unidad de almacenamiento de información y unidad de herencia al transmitir esa información a la descendencia. La realización de esta función no requiere de la traducción del gen ni tan siquiera su trascripción. Esto significa que los genes controlan la estructura de todas las proteínas del organismo, incluyendo las enzimas. Cada cromosoma puede contener cientos o miles de genes. Por ejemplo, se cree que el ser humano tiene unos cincuenta mil genes o más, aunque no se conoce la cantidad exacta. Cada gen ocupa en el cromosoma una posición determinada llamada locus. El conjunto de genes de una especie se denomina genoma.
El genoma es todo el material genético contenido en los cromosomas de un organismo en particular. En el caso del humano su genoma tiene 3.000 millones de nucleótidos. Aplicado al humano, el genoma se refiere sólo al ADN cromosómico. Aunque la mitocondria contiene genes, estos genes no son considerados “genoma”. El término diploide describe el número completo de copias del genoma en una célula determinada.
Con el apoyo de las técnicas de la biología molecular se ha profundizado en el concepto del gen o gene. Al tener la posibilidad de conocer su ultraestructura fina, se ha llegado a varias conclusiones. Una de las primeras conclusiones es que en el genoma de los organismos superiores, la mayor parte es de tipo inoperante, es decir que no determina ninguna proteína, o ARN. En el hombre se calcula que el ADN, en apariencia “inútil”, está entre 80% y el 90%, pudiendo presentarse este ADN en secuencias repetidas hasta en algunos millares de veces, constituyendo las secuencias no repetidas (únicas), más la excepción, que la regla.
Debido a que los genes de los organismos eucariotas presentan secuencias codificadoras, llamadas exones, intercaladas entre secuencias de ADN “inútil” (es decir secuencias de ADN que se traducen y no se transcriben), llamados intrones, se dice que los genes están fragmentados.
Por otra parte, el descubrimiento de los genes partidos o fragmentados ha venido a modificar conceptos que se tenían sobre la evolución y filogenia de los genes y ha sugerido nuevas ideas sobre el origen de las proteínas. Muchas proteínas actuales podrían ser resultado de la fusión de proteínas más sencillas, existentes en una fase más primitiva de la evolución de la vida. Los exones podrían corresponder a los genes que controlan a la síntesis de dichas proteínas primitivas. La existencia de intrones en algunos genes de las protobacterias da cierta base a esta interpretación (Gilbert, 1986).
De todo ello, surgen nuevos conocimientos sobre la estructura y dinámica del genoma que arrojan nuevas hipótesis acerca de las relaciones filogenéticas y evolutivas entre los organismos. En virtud que se estimó que hasta un 90% del ADN pueden ser de tipo inoperante, a ese ADN por no ser del tipo codificante, en un principio se le llamo “inútil” (basura)
Por el contrario, en el ADN de los procariotas (como las bacterias) los genes están desprovistos de intrones. Esta circunstancia y el hecho que se descubriera que la mitocondria (en humanos) exhibe este mismo patrón con genes contiguos, muy próximos unos de otros, dio pie para que se hablara de una evolución de los organismos por economía de ADN y sirvió para reforzar la teoría endosimbiótica, la cual plantea que, en un principio, las mitocondrias eran bacterias que mediante la evolución intracelular dieron origen a los organelos actuales.
La mayoría de los genes analizados en mamíferos, aves y anfibios presentan intrones. También se han encontrado intrones en algunos genes de insectos, aunque en estos parecen ser menos frecuentes. Igualmente se han encontrado en el genoma de las mitocondrias (excepto en humanos), cloroplastos y en virus de animales. Sin embargo, en procariotas no se han encontrado.
Otra visión actual del genoma es el conocimiento que se tiene sobre la multiplicación génica que da lugar a las familias multigénicas.
Por otra parte, ciertas secuencias poseen la propiedad de ser “móviles” o “transponibles” en el genoma. Estas descubiertas originalmente en el maíz por Barbara McClintock, en 1940.
Un ejemplo de secuencias móviles se presenta con la inactivación del gen que modifica el color de los ojos en la mosca de la fruta Drosophila. Muchas veces en los vertebrados se encuentran secuencias de ADN que provienen de retrovirus libres. Estos provirus, están repetidos, son transponibles y pueden, o no, ser codificadores. Aún y cuando no sea una secuencia codificadora, si se inserta en la región reguladora de un gen, su expresión puede verse afectada.
Hoy, gracias a los avances de la biología molecular, y en particular a las técnicas de la ingeniería genética, se asiste a una auténtica manipulación genética del ser vivo: aislando, clonando e insertando genes a voluntad, logrando con ello evadir las barreras que la evolución ha impuesto por miles y hasta millones de años. La distancia evolutiva que, por ejemplo, separaba a las bacterias Implicaciones éticas de la biotecnología.
La idea de gen, aunque no significara siempre lo mismo, a servido de hilo conductor de la historia de la biología moderna. En el siglo XIX, Gregorio Mendel demostraba que los rasgos característicos de los organismos estaban determinados por unos “factores” hereditarios, presentes en las células germinales. El biólogo danés Wilhelm Johannsen llamó genes ha esos factores. A principios del siglo XX los genes se definieron como elementos discretos dispuestos de forma lineal en los cromosomas.
El concepto actual de gen es considerado como la unidad de almacenamiento de información y unidad de herencia al transmitir esa información a la descendencia. La realización de esta función no requiere de la traducción del gen ni tan siquiera su trascripción. Esto significa que los genes controlan la estructura de todas las proteínas del organismo, incluyendo las enzimas. Cada cromosoma puede contener cientos o miles de genes. Por ejemplo, se cree que el ser humano tiene unos cincuenta mil genes o más, aunque no se conoce la cantidad exacta. Cada gen ocupa en el cromosoma una posición determinada llamada locus. El conjunto de genes de una especie se denomina genoma.
El genoma es todo el material genético contenido en los cromosomas de un organismo en particular. En el caso del humano su genoma tiene 3.000 millones de nucleótidos. Aplicado al humano, el genoma se refiere sólo al ADN cromosómico. Aunque la mitocondria contiene genes, estos genes no son considerados “genoma”. El término diploide describe el número completo de copias del genoma en una célula determinada.
Con el apoyo de las técnicas de la biología molecular se ha profundizado en el concepto del gen o gene. Al tener la posibilidad de conocer su ultraestructura fina, se ha llegado a varias conclusiones. Una de las primeras conclusiones es que en el genoma de los organismos superiores, la mayor parte es de tipo inoperante, es decir que no determina ninguna proteína, o ARN. En el hombre se calcula que el ADN, en apariencia “inútil”, está entre 80% y el 90%, pudiendo presentarse este ADN en secuencias repetidas hasta en algunos millares de veces, constituyendo las secuencias no repetidas (únicas), más la excepción, que la regla.
Debido a que los genes de los organismos eucariotas presentan secuencias codificadoras, llamadas exones, intercaladas entre secuencias de ADN “inútil” (es decir secuencias de ADN que se traducen y no se transcriben), llamados intrones, se dice que los genes están fragmentados.
Por otra parte, el descubrimiento de los genes partidos o fragmentados ha venido a modificar conceptos que se tenían sobre la evolución y filogenia de los genes y ha sugerido nuevas ideas sobre el origen de las proteínas. Muchas proteínas actuales podrían ser resultado de la fusión de proteínas más sencillas, existentes en una fase más primitiva de la evolución de la vida. Los exones podrían corresponder a los genes que controlan a la síntesis de dichas proteínas primitivas. La existencia de intrones en algunos genes de las protobacterias da cierta base a esta interpretación (Gilbert, 1986).
De todo ello, surgen nuevos conocimientos sobre la estructura y dinámica del genoma que arrojan nuevas hipótesis acerca de las relaciones filogenéticas y evolutivas entre los organismos. En virtud que se estimó que hasta un 90% del ADN pueden ser de tipo inoperante, a ese ADN por no ser del tipo codificante, en un principio se le llamo “inútil” (basura)
Por el contrario, en el ADN de los procariotas (como las bacterias) los genes están desprovistos de intrones. Esta circunstancia y el hecho que se descubriera que la mitocondria (en humanos) exhibe este mismo patrón con genes contiguos, muy próximos unos de otros, dio pie para que se hablara de una evolución de los organismos por economía de ADN y sirvió para reforzar la teoría endosimbiótica, la cual plantea que, en un principio, las mitocondrias eran bacterias que mediante la evolución intracelular dieron origen a los organelos actuales.
La mayoría de los genes analizados en mamíferos, aves y anfibios presentan intrones. También se han encontrado intrones en algunos genes de insectos, aunque en estos parecen ser menos frecuentes. Igualmente se han encontrado en el genoma de las mitocondrias (excepto en humanos), cloroplastos y en virus de animales. Sin embargo, en procariotas no se han encontrado.
Otra visión actual del genoma es el conocimiento que se tiene sobre la multiplicación génica que da lugar a las familias multigénicas.
Por otra parte, ciertas secuencias poseen la propiedad de ser “móviles” o “transponibles” en el genoma. Estas descubiertas originalmente en el maíz por Barbara McClintock, en 1940.
Un ejemplo de secuencias móviles se presenta con la inactivación del gen que modifica el color de los ojos en la mosca de la fruta Drosophila. Muchas veces en los vertebrados se encuentran secuencias de ADN que provienen de retrovirus libres. Estos provirus, están repetidos, son transponibles y pueden, o no, ser codificadores. Aún y cuando no sea una secuencia codificadora, si se inserta en la región reguladora de un gen, su expresión puede verse afectada.
Hoy, gracias a los avances de la biología molecular, y en particular a las técnicas de la ingeniería genética, se asiste a una auténtica manipulación genética del ser vivo: aislando, clonando e insertando genes a voluntad, logrando con ello evadir las barreras que la evolución ha impuesto por miles y hasta millones de años. La distancia evolutiva que, por ejemplo, separaba a las bacterias y al hombre ha sido franqueada. La célula ha sido convertida en una fábrica capaz de albergar y atender las instrucciones que le proporcionan genes ajenos, que le son insertados para la obtención de moléculas biológicas. Los nuevos organismos que el hombre está diseñando en pos de mayor cantidad, o mejor calidad de satisfactores, lo ha llevado a ocupar una nueva posición en la naturaleza. De desempeñarse como protagonista, está pasando a asumir las facultades y responsabilidades de su dirección.
Transgénicos.
Ya se ha mencionado que el crecimiento de la población humana ha llegado a límites inimaginables por Malthus, o cualquiera de los grandes personajes del siglo XVIII. En la actualidad, con más de siete mil millones de bocas qué alimentar, se deben buscar alternativas que nos permitan optimizar la producción de alimentos.
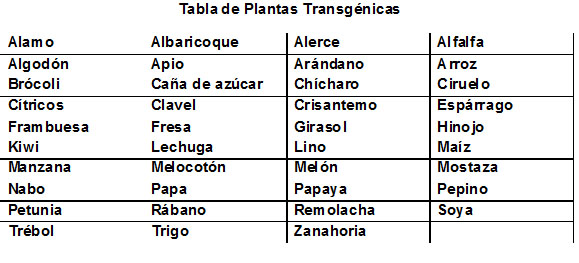
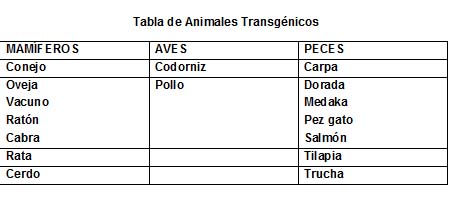
Una de las aplicaciones de las tecnologías surgidas de la manipulación del ADN tiene qué ver con cultivos más productivos. Por ejemplo, el maíz es atacado por una variedad de insectos que merman sustancialmente las cosechas. Así, se localizó una bacteria, llamada Bacillus thuringiensis que produce naturalmente un insecticida. Un equipo de científicos comandado por lograron aislar el gene bacteriano responsable de la producción de la proteína con propiedades insecticidas, lo insertaron en un vehículo de ADN y lo insertaron en células de maíz, logrando así una variedad de maíz transgénico llamado Maíz Bt (por las siglas de la bacteria donadora). Su cultivo incrementó por mucho la productividad, por lo que se han generado variedades Bt de otras tantas variedades de maíz, de papa y de soya.
Esta técnica ha permitido desarrollar una diversidad de plantas transgénicas como pueden ser:
El trabajo con animales es un poco más delicado, pero desde luego que también se ha hecho. Uno de los ejemplos más interesantes tiene qué ver con la diabetes tipo 1, que es aquélla que se presenta en niñós, jóvenes o adultos jóvenes (se puede presentar a cualquier edad y en el mundo existen unos 35 millones de personas con este tipo específico de padecimiento), y que es dependiente de la insulina. Estos pacientes, requieren dosis diaria de la hormona insulina, la cual es una proteína formada por dos cadenas de aminoácidos (a. a.); la cadena A tiene 21 a. a. y la cadena B que tiene 30 a. a. En el pasado, la insulina se extraía de las glándulas pancreáticas de los cerdos que se sacrifican para alimento en todo el mundo. No obstante, aunque la insulina porcina es casi idéntica a la de los humanos, difiere en el último aminoácido, ya que ellos en el último aminoácido de la cadena B tienen alanina en lugar de treonina. También se llegóa a usar insulina de res, pero esta difiere en tres aminoácidos.
Desde la década de 1980, se logró introducir al mercado farmacéutica una insulina humana de origen transgénico. En la actualidad, existen compañías que comercializan esta hormona transgénica obtenida de bacterias o levaduras. En este caso, se localizó y aisló el gen humano para la síntesis de esta proteína, se introdujo en un plásmido y se insertó en la célula diana como se indica en la figura 2 La insulina humana fue la primera proteina transgénica que fue autorizada para su uso farmacéutico.
Se han obtenido una variedad de animales transgénicos; muchos de ellos para obtener medicamentos del semen de los machos o de la leche de las hembras de algunos mamíferos. Algunos ejemplos son:
Si analizas y comparas los esquemas 3.2.8, 9 y 10, que son respectivamente el esquema básico del ADNr, el esquema de creación del maíz transgénico y el de creación de la insulina transgénica, son esencialmente iguales: un gen de interés, un vehículo para transportarlo, que en los tres casos es un plásmido, su integración en un solo anillo de ADN, y su inserción en la célula diana. La gran mayoría de técnicas de inserción de ADN es semejante. Ciertamente puede variar el vehiculo, un plásmido, un cósmido o hasta un virus; puede haber otras sutilezas, pero la idea es la misma.
Presentación: Organismos genéticamente transformados
Presentación: Ejemplos de organismos genéticamente transformados
Proyecto genoma humano.
Genoma. Del griego gen: generar, que genera, y –oma: acción. Término acuñado por el alemán Hans Winkler en 1920, usando las contracciones de las palabras gene y cromosomas. En el caso de las células eucariontes, el genoma es: “La totalidad del ADN incluyendo todos sus genes, contenido en una célula, que incluye al ADN de los cromosomas dentro del núcleo y al ADN de las mitocondrias (y de los cloroplastos en el caso de células vegetales)”. En el caso de las células procariontes, será la totalidad del ADN de su cromosoma, más el contenido en el o los plásmidos, ya que no tienen mitocondrias, núcleo ni cloroplastos. Por lo tanto, el genoma es la dotación hereditaria de cada organismo, que incluye a todos los sistemas vivos y a los virus. En el caso de algunos virus el material genético es de ARN y por lo tanto, cuando se habla de su genoma se habla de su ARN
Desde luego que cada dotación genética contiene la información total del individuo codificada en el ordenamiento de los nucleótidos de cada uno de sus genes. En el caso de los seres humanos, el genoma nuclear tiene tres mil millones de bases nitrogenadas en una de las cadenas del DNA. En el caso de los individuos de reproducción sexual la información es reordenada y transmitida a los descendientes (recombinación genética), por lo que el genoma de un individuo no es igual al de otros individuos de su misma especie, pero se sabe que en los humanos la coincidencia es de aproximadamente el 99%, existiendo sólo una pequeña fracción diferente, razón por la cual genéticamente no existen razas en los humanos y se puede encontrar mayor diferencia contrastando la información genética entre dos individuos de una misma “raza” que en una contrastación “interracial”.
Para las especies eucariontes se acepta que el genoma es todo el ADN en un número haploide de cromosomas. En 1990 surgió el Proyecto genoma humano con la intensión de conocer el orden de todos los nucleótidos en el genoma humano. La información a la que se le llama secuencia sería más o menos de la siguiente manera:
GCTCAATCTACCGAGATGTAACGATTAATCGATCGAATTACCGACTTCGAGCACAGTATACCTGGATTCAACGTTA
Conocida la secuencia se procede a identificar los genes (se identifican las secuencias de iniciación y terminación de acuerdo al código genético) y para que proteínas codifican, con la finalidad de crear mapas de genes, para ubicarlos en sus respectivos cromosomas locus y conocer sus funciones.
Otras aplicaciones del conocimiento del genoma es hacer comparaciones entre especies para conocer su grado de parentesco evolutivo, por ejemplo, al comparar el genoma humano con el de otros primates se ha descubierto que compartimos una mayor afinidad genética con chimpancés que con gorilas y orangutanes. También se puede aplicar el conocimiento del genoma humano para: Diagnóstico y prevención de enfermedades. En el caso de enfermedades, hacer pronósticos sobre posibilidad del desarrollo de la enfermedad en personas sanas asintomáticos y en sus descendientes, posibles prevenciones y tratamiento, como la terapia génica (introducción de genes en el ADN de una persona para tratar una enfermedad) y farmacogenómica (crear fármacos a la medida del enfermo). También tiene aplicaciones en genómica microbiana, medicina molecular, bioarqueología, antropología, estudio de migraciones, paleogenética, e identificación de individuos entre otros.
Qué fue el proyecto genoma humano y cuál fue su importancia. El proyecto genoma humano fue una investigación internacional con un presupuesto de 3,000 millones de dólares, para determinar la secuencia del genoma humano e identificar los genes contenidos en él. El proyecto se fundo en 1990 y fue coordinado por el Instituto Nacional de Salud “The National Institutes of Health” y el Departamento de Energía “Department of Energy” de los Estados Unidos, en colaboración con Universidades del mismo país, así como universidades del Reino Unido, Francia, Alemania, Japón y China. El Proyecto Genoma Humano comenzó en 1990 y fue concluido en el 2003, dos años antes de lo previsto. Este Proyecto ha permitido a los investigadores conocer el patrón o secuencia de bases nitrogenadas en el DNA que permite la construcción y mantenimiento de un ser humano. Por lo tanto, conocer las funciones de los genes y las proteínas, tendrá un impacto mayúsculo en los campos de la medicina y la biotecnología.
Cuáles fueron los objetivos del proyecto genoma humano. Los principales objetivos del Proyecto Genoma Humano fueron obtener con precisión la secuencia de los tres mil millones de pares de bases nitrogenadas del DNA del genoma humano y, encontrar los veinte mil o veinticinco mil genes que se estimaba contenía dicho genoma. Información equivalente a unos 750 megabytes de información digitalizada, que llenaría unos 5,000 libros de aproximadamente 350 paginas y que aún así, dicha información, cabe en un DVD. Otro objetivo fue secuenciar el genoma de algunos otros organismos de importancia médica, como la mosca de la fruta y el ratón.
Además de la secuenciación del DNA, el Proyecto Genoma Humano requirió del desarrollo de nuevas herramientas tecnológicas para obtener y analizar los datos, además de tener disponible la información para todo público, debido a que los avances adquiridos tendrían consecuencias importantes para los individuos y la sociedad en su conjunto. Por lo tanto, el Proyecto Genoma Humano se comprometió a explorar las consecuencias de la investigación en genómica a través de sus implicaciones éticas y legales en un programa llamado “ELSI” (Ethical, Legal, and Social Implications”)
En abril de 2003, los investigadores del Proyecto anunciaron que la secuenciación completa del genoma humano se había realizado con éxito (dos años antes de lo previsto). Lo anterior permitió mejorar el bosquejo del genoma que se había publicado en 2001, se habían identificado varios genes humanos y se daba información acerca de su estructura y organización. Los datos de dichas secuencias y las herramientas para analizarlos estuvieron disponibles de manera gratuita en Internet. También, se secuenciaron los genomas de algunos otros organismos (levaduras, nematodos y moscas de la fruta), logrando en 2002 el bosquejo del genoma de una especie de roedor (Rattus norvegicus). Estudiando las variaciones entre los genes humanos y los genes de otros organismos se descubrieron las funciones de algunos de ellos, permitiendo identificar cuales genes son peligrosos.
Cuáles fueron las implicaciones éticas, legales y sociales asociadas al Proyecto Genoma Humano. El programa ELSI se fundó en 1990 como parte integral del Proyecto Genoma Humano (PGH). La misión del programa fue identificar y ubicar los problemas generados a partir de la investigación del genoma. Un porcentaje del presupuesto del Proyecto Genoma Humano fue destinado para la investigación del programa ELSI.
El Programa se enfocó en las posibles consecuencias de las investigaciones del PGH en las siguientes áreas:
1. Privacidad y justicia en el uso de la información, incluyendo la potencial discriminación genética, de empleo y de aseguramiento (médico o de vida) 2. La integración de las nuevas tecnologías en genética, tales como; pruebas genéticas dentro de la práctica de la medicina clínica. 3. Problemas éticos relacionados con el diseño y conducción de la investigación con personas, incluyendo el proceso de consentimiento de una persona, para ser sometida a una prueba genética y la importancia de entender los beneficios y limitaciones de la prueba, así como de sus posibles consecuencias. 4. La información a los profesionales de la salud, a los formadores de opinión, estudiantes y público en general acerca de los problemas que resulten de la investigación genómica.
Importancia del conocimiento del genoma humano. El objetivo principal es saber que hace cada gene humano identificado y, vincular las variaciones existentes en la secuencia de cada gene entre individuos, con la posibilidad de desarrollar diversas enfermedades. Esto permitirá en un futuro que cada individuo tenga una tarjeta personalizada que especifique el riesgo personal de contraer ciertas enfermedades comunes, como diabetes y cardiopatías entre otras y también la información sobre su tolerancia a ciertos fármacos y así poderles proporcionar tratamientos más eficaces. Desde luego esta posibilidad suena muy bien, pero habría que evaluar sus repercusiones sociales, sobre todo con la estigmatización a ciertos genomas y las posibilidades de que una vez conocido el genoma de una persona, este se pueda usar en su contra y no darle oportunidad de obtener un empleo o de poder obtener un seguro médico o de vida si el sujeto es un individuo de alto riesgo por sus genes. También la información sobre el genoma dará la posibilidad e la aplicación de terapias génicas para reemplazar o modificar genes defectuosos con la finalidad de curar enfermedades hereditarias y cáncer (sería imposible curar el cáncer sin comprender primero la función de los genes productores y de los genes supresores de cáncer en el desarrollo de tumores). La comparación entre las secuencias de algunos genes humanos con secuencias equivalentes en primates cercanos evolutivamente a nosotros develan nuestra trayectoria evolutiva a lo largo de entre cinco y seis millones de años. Los estudios del genoma humano también han servido para conocer los movimientos migratorios de la población que dejó África hace entre 60 y 70 mil años y como se han dispersado a lo largo y ancho del planeta. Una vez obtenida la secuenciación del genoma humano, lejos de terminar el trabajo, el trabajo apenas comienza, para que los nuevos conocimientos puedan ser utilizados, comprender qué significa cada secuencia y que podemos hacer con ese conocimiento.
Terapia génica.
Las técnicas del ADNr, así como las que se han ido derivando de su desarrollo, se han tratado de aplicar en diversos campos, incluso el de la salud humana. Esto, debido a que se ha averiguado que muchas enfermedades que nos afectan, tienen un origen genético. Los investigadores han logrado identificar y aislar tanto los genes no adaptativos (los que producen enfermedad), como los adaptativos (los presentes en individuos sanos). Asimismo, se han desarrollado técnicas para introducir en las células no funcionales copias sanas del gen en cuestión. A estos procedimientos, se les ha denominado Terapia Génica.
La terapia génica consiste en la administración deliberada de material genético en un paciente humano con la intención de corregir un defecto genético específico. Debido a su relativa facilidad de tratamiento, las enfermedades hematopoyéticas (aquéllas que tienen que ver con las células sanguíneas), han sido de las más beneficiadas con estas técnicas. Principalmente diversos tipos de anemias, como la Beta Talasemia.
La beta talasemia es una enfermedad producida por un desorden genético que afecta la producción de la proteína beta- globulina. Esto hace que el paciente requiera de transfusiones frecuentes para permanecer con vida. En estos casos, se han desarrollado protocolos llamados ex situ, que se les llama así por que se extraen tejidos de médula ósea para, en condiciones de laboratorio, insertar el gen sano en las células y después reinsertar ese tejido. Se entiende que la inserción del gen sano se hace mediante las técnicas que ya conocemos de ADNr, aunque en este caso, el ADN foráneo pertenece a la misma especie (Homo sapiens sapiens).
No cabe duda que la terapia génica es la gran promesa de salud para el futuro, pues se están investigando múltiples aplicaciones que muy probablemente estarán en uso en las décadas por venir. Algunos ejemplos de enfermedades investigadas son:
ADA. Esta carencia genética provoca deficiencia de adenosín de aminasa originando un trastorno de la inmunidad. La terapia consiste en introducir antígenos en células tumorales permitiendo que las células inmunes puedan reconocer a las células tumorales.
Cáncer. Se están trabajando al menos cinco líneas de investigación que incluyen desde manipulación de médula ósea hasta unos genes llamados suicidas, ya que codifican para la susceptibilidad a drogas que de otra manera no serían tóxicas, pero que al estar presentes en tumores malignos, provocan su destrucción.
Síndrome de Wiskott-Aldrich (WAS) se presenta mas frecuentemente en hombres, ya que es un gen recesivo ubicado en el cromosoma X. provoca eczema (ronchas en la piel), infecciones recurrentes, inmunodeficiencia, linfomas y enfermedades autoinmunes. La terapia es ex situ, pues se extraen células madre de la médula ósea, se le inserta el gen sano y se vuelven a reinstalar en el paciente.
Secuenciación de ADN
El conocimiento de la secuencia de bases nitrogenadas del ADN es de gran importancia teórico – práctica, ya que entraña la información completa de las proteínas que constituyen a una especie. Y se realiza gracias a un conjunto de técnicas derivadas de la manipulación del ADN.
En sentido estricto, se considera como un conjunto de métodos y técnicas bioquímicas cuya finalidad es la determinación del orden de los nucleótidos (adenina, Timina, Citosina y Guanina) en un oligonucleótido de ADN. Cualquier secuenciación se debe leer de 5´ a 3´ y de izquierda a derecha. Recuerda que cinco prima y tres prima tienen qué ver con la desoxirribosa, que se enlazan una con otra mediante un puente de fósforo (ver figura 3.43), y los carbonos involucrados son precisamente el 5 (que porta el grupo fosfato), y el 3.
Hacia la década de 1980, se tenía ya la tecnología suficiente para averiguar la totalidad del genoma humano. Uno de los principales promotores de que esta tarea se realizara, fue James D. Watson, personaje legendario que junto con Crick y Wilkins, recibieron el premio Nobel en 1962 por el descubrimiento de la estructura molecular del ADN. Así, en 1990, con un presupuesto de 280 000 millones de dólares para un período de 15 años, se instaló el Proyecto HUGO (por Human Genome Organization), nombrando director a Watson.
El Proyecto HUGO es el más caro de la historia, por encima del Proyecto Manhattan, que llevó a la creación de la bomba atómica a principios de la década de 1940. Gracias a la participación internacional y a la evolución de las tecnologías disponibles, el proyecto se terminó antes, en 2003.
Los resultados de secuenciación del genoma humano es que en el caso haploide (el número haploide es un cromosoma de cada par de ellos; es decir solo cromosomas nones que tenemos en número de 23), tiene una longitud total aproximada de 3200 millones de pares de bases nitrogenadas (3200 Mb), que contienen unos 20 500 genes. Pero lo interesante es que se conoce la secuencia de bases, aunque cada persona tiene una secuencia individual; actualmente se esta estudiando la distribución geográfica de ciertos marcadores genéticos.
Pero no solo el genoma humano ha sido secuenciado, sino que también poco más de 180 especies de importancia científica han sido trabajadas. Algunos ejemplos son: una variedad de bacterias como diversas especies de Bacillus, Haemophillus influenciae, Brucella suis, Methylococcus capsulatus; la levadura de cerveza (Saccharomyces cerevisiae); insectos como la abeja europea melífera (Apis mellifera), el mosquito Anopheles gambiae o la mosca de la fruta (Drosophila melanogaster); peces como Tetraodon nigroviridis; aves como el pollo (Gallus gallus), mamíferos como el perro (Canis familiaris), la rata (Rattus norvegicus) y el chimpancé (Pan troglodytes). Y desde luego, plantas como el arroz (Oryza sativa).
Lectura: Llega al Mercado detector de genes fetales
Implicaciones éticas de la biotecnología moderna.
¿Es todo bueno en la manipulación del DNA? El desconocimiento de las posibles consecuencias en el ambiente y en la salud es el mayor peligro de la ingeniería genética.
Hacer modificaciones a los seres vivos no es cosa de juego, sobre todo cuando el equilibrio de la vida en la tierra es muy frágil, ya que todos los que aquí habitamos dependemos de otros para sobrevivir.
El peligro de cultivar organismos transgénicos radica en que la mayoría de las plantas se reproducen intercambiando polen entre miembros de su misma especie y con algunos parientes silvestres. Esta forma de reproducción es la que puede provocar la contaminación genética, ya que al implantar organismos transgénicos en el medio ambiente, se libera al mismo tiempo el polen transgénico y no se sabe que le puede suceder a los insectos polinizadores o a las abejas cuando consuman miel de una planta que produce su propio insecticida.
Hasta que se demuestre lo contrario es posible que la propagación de los genes modificados pueda poner en peligro a las especies existentes.
No se han realizado estudios para determinar el impacto de los productos transgénicos en el ambiente y eso es alarmante, puesto que los efectos ocasionados por nuevos organismos solo puede evaluarse 20 ó 30 años después de que se liberan en el ambiente, cuando los cambios ya sean incontrolables e irreversibles.
La naturaleza no siempre reacciona positivamente ante un organismo extraño y los cambios que se produzcan en el ambiente pueden tardar hasta 20 años en detectarse.
En materia de salud humana no se sabe que consecuencias pueden traer a mediano y largo plazo el consumo de productos transgénicos. Sin embargo se sabe que ciertos cultivos transgénicos, a los cuales les insertaron genes de resistencia a antibióticos, pueden generar bacterias que causan enfermedades o resistencia a antibióticos en humanos y animales. Esto quiere decir que quienes consuman cultivos transgénicos con resistencia a los antibióticos, podrían tener dificultad para combatir infecciones.
Manipular la vida no es cosa de juego, por eso, la preocupación de muchos científicos no es hasta dónde podemos llegar, sino hasta dónde debemos llegar.
A pesar de los avances de la biología molecular, la ingeniería genética está en sus primeros pasos y falta mucho por conocer. Por ello, es preciso tener cautela con esta tecnología tan reciente, para no cometer errores que pongan en peligro la biodiversidad de la tierra.
Las empresas transnacionales cada día presionan más a los gobiernos para que liberen la introducción de productos transgénicos. Bioseguridad o la urgencia de regular los transgénicos.
La bioseguridad consiste en el manejo seguro de organismos vivos, con la finalidad de evitar catástrofes. Ante el peligro que representa la propagación de organismos transgénicos en el ambiente, en 1992 en la Cumbre de la Tierra celebrada en Río de Janeiro, Brasil, 175 países establecieron la necesidad de crear un Protocolo de Bioseguridad con reglas internacionales para el manejo, uso y movimiento transfronterizo de los organismos transgénicos bajo el criterio de la precaución.
En febrero de 1999 se llevó a cabo, en Cartagena, Colombia, la reunión para la firma del Protocolo de Bioseguridad, en donde 135 países estaban de acuerdo con la firma del Protocolo y coincidían en poner énfasis en la precaución y, sin embargo, las presiones del gobierno de Estados Unidos y cinco países más: Australia, Argentina, Chile, Uruguay, Canadá y el Grupo Miami impidieron la firma del Protocolo. Nuevamente los intereses económicos de unos cuantos pudieron más que la sensatez y la prevención. A pesar de todo la discusión no ha terminado y la firma del acuerdo debe conseguirse para antes del 2000 pues es una cuestión que no debe esperar más.
Greenpeace en campaña o la herramienta para impedir la liberación de transgénicos.- Desde hace varios años, Greenpeace lleva a cabo una campaña en contra de la liberación de organismos transgénicos, por el riesgo que representan y los posibles efectos negativos que ejercen sobre el equilibrio natural de los ecosistemas, la biodiversidad, la salud humana y animal.
México cuenta con una gran riqueza biológica y es centro de origen y diversidad de muchos cultivos, por lo tanto, se lleva a cabo una campaña en contra de la propagación de maíz transgénico en nuestro territorio, pues son graves los riesgos que éste representa para nuestro país, sobre todo porque somos centro de origen de dicho cultivo tan importante para los mexicanos y el mundo.
La posición de Greenpeace es clara y está en contra de la voracidad de las grandes empresas transnacionales como Monsanto, Novartis, AgrEvo, La Moderna y otras que expone al ambiente a la contaminación genética y buscan la imposición de productos alimenticios, como el nuevo rostro del colonialismo.
Greenpeace no rechaza el avance científico, ya que puede proporcionar alternativas más seguras y económicas, que permitan un desarrollo tecnológico sustentable que se adapte mejor a las condiciones y necesidades de cada región.
Linea de tiempo de la Historia de la genética
Lectura: *Bioética: Entrevista con Hank Greely