Diferencia entre revisiones de «Tema 1. Bases moleculares del metabolismo.»
| (No se muestran 33 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | + | '''''Aprendizaje.''''' | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | '''''El alumno:''''' | |
| − | + | '''''Compara el anabolismo y catabolismo como procesos de síntesis y degradación para la conservación de los sistemas biológicos.''''' | |
| − | • '''Metabolismo: Anabolismo y Catabolismo | + | '''''Relaciona los carbohidratos, lípidos, proteínas y nucleótidos con los procesos metabólicos de transformación de energía.''''' |
| + | |||
| + | '''''Comprende el papel de las enzimas en las reacciones metabólicas.''''' | ||
| + | |||
| + | |||
| + | • '''Metabolismo: Anabolismo y Catabolismo''' | ||
| − | |||
Como puedes observar en el título de esta unidad, el eje es la conservación de los sistemas biológicos, de modo que lo primero que debemos hacer es dejar en claro a qué nos referimos con conservación. El término proviene del latín conservatio, que es la acción y efecto de conservar (mantener, cuidar o guardar algo, e incluso continuar con la práctica de costumbres). En este caso, nos referiremos al mantenimiento de los sistemas vivos; tanto en su constitución y el mantenimiento de éste a través del tiempo, así como a la degradación de ciertas moléculas para afrontar el gasto energético que implica su manifestación como ser viviente. | Como puedes observar en el título de esta unidad, el eje es la conservación de los sistemas biológicos, de modo que lo primero que debemos hacer es dejar en claro a qué nos referimos con conservación. El término proviene del latín conservatio, que es la acción y efecto de conservar (mantener, cuidar o guardar algo, e incluso continuar con la práctica de costumbres). En este caso, nos referiremos al mantenimiento de los sistemas vivos; tanto en su constitución y el mantenimiento de éste a través del tiempo, así como a la degradación de ciertas moléculas para afrontar el gasto energético que implica su manifestación como ser viviente. | ||
| Línea 19: | Línea 20: | ||
Así, podemos afirmar que un ser vivo es un sistema que intercambia materia y energía con el medio externo y que tal intercambio no es aleatorio, pues está controlado por el propio organismo (aunque con gran frecuencia el ambiente presenta, estacionalmente, limitaciones en la oferta de algunos de sus componentes. Por ejemplo: la lluvia, la temperatura, la cantidad de luz, etc.). Ciertamente, el organismo se encarga de administrar sus insumos para realizar todas sus funciones: tanto para fabricar sus componentes estructurales y funcionales, como para darse automantenimiento y realizar el manejo energético que le permita manifestarse como ente vivo, pero al mismo tiempo elimina desechos (ver figura 1). | Así, podemos afirmar que un ser vivo es un sistema que intercambia materia y energía con el medio externo y que tal intercambio no es aleatorio, pues está controlado por el propio organismo (aunque con gran frecuencia el ambiente presenta, estacionalmente, limitaciones en la oferta de algunos de sus componentes. Por ejemplo: la lluvia, la temperatura, la cantidad de luz, etc.). Ciertamente, el organismo se encarga de administrar sus insumos para realizar todas sus funciones: tanto para fabricar sus componentes estructurales y funcionales, como para darse automantenimiento y realizar el manejo energético que le permita manifestarse como ente vivo, pero al mismo tiempo elimina desechos (ver figura 1). | ||
| − | <center>[[Archivo:Goyo.jpg]]</center> | + | <center>[[Archivo:Goyo.jpg|700px]]</center> |
| − | Figura 1. Los sistemas vivos tenemos insumos y desechos; asimismo, parte de los insumos generan biomasa, la cual sufre recambio y puede ser desechada y vuelta a construir. | + | <center>Figura 1. Los sistemas vivos tenemos insumos y desechos; asimismo, parte de los insumos generan biomasa, la cual sufre recambio y puede ser desechada y vuelta a construir.</center> |
| + | |||
Cualesquiera que sean los usos a que se reserven los recursos obtenidos, es importante señalar que tales insumos no pueden ser manejados en crudo; el organismo debe darles un tratamiento bioquímico para disponer de ellos, y, como ya hemos visto, a toda la serie de reacciones bioquímicas que ocurren en un organismo se les da el nombre de metabolismo. | Cualesquiera que sean los usos a que se reserven los recursos obtenidos, es importante señalar que tales insumos no pueden ser manejados en crudo; el organismo debe darles un tratamiento bioquímico para disponer de ellos, y, como ya hemos visto, a toda la serie de reacciones bioquímicas que ocurren en un organismo se les da el nombre de metabolismo. | ||
| Línea 29: | Línea 31: | ||
Dependiendo del tipo de reacción bioquímica de que se trate, el metabolismo se divide en Anabolismo y Catabolismo. Todas las reacciones de síntesis, que casi invariablemente son endoenergéticas (es decir, que requieren de una fuente de energía para realizarse), se clasifican como anabólicas. Por su parte, las reacciones catabólicas son reacciones que implican el rompimiento de una molécula grande en dos o más moléculas más pequeñas, frecuentemente acompañadas de una liberación de energía (reacciones exoenergéticas). | Dependiendo del tipo de reacción bioquímica de que se trate, el metabolismo se divide en Anabolismo y Catabolismo. Todas las reacciones de síntesis, que casi invariablemente son endoenergéticas (es decir, que requieren de una fuente de energía para realizarse), se clasifican como anabólicas. Por su parte, las reacciones catabólicas son reacciones que implican el rompimiento de una molécula grande en dos o más moléculas más pequeñas, frecuentemente acompañadas de una liberación de energía (reacciones exoenergéticas). | ||
| − | + | <center>[[Archivo:Anacata.jpg]]</center> | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
La célula presenta compuestos bioquímicos que absorben o liberan energía y que van aparejados a las reacciones antes señaladas que evitan un derroche energético que pudiese incrementar peligrosamente la temperatura corporal. Estos intermediarios energéticos son generalmente compuestos fosforilados, siendo los más conocidos los fosfatos de adenosina: el difosfato y el trifosfato de adenosina (ADP y ATP). | La célula presenta compuestos bioquímicos que absorben o liberan energía y que van aparejados a las reacciones antes señaladas que evitan un derroche energético que pudiese incrementar peligrosamente la temperatura corporal. Estos intermediarios energéticos son generalmente compuestos fosforilados, siendo los más conocidos los fosfatos de adenosina: el difosfato y el trifosfato de adenosina (ADP y ATP). | ||
| Línea 42: | Línea 39: | ||
<center>[[Archivo: ADP-ATP.jpg]]</center> | <center>[[Archivo: ADP-ATP.jpg]]</center> | ||
| − | Figura 2. Representa los componentes del Adenosín trifosfato (ATP), así como el ADP y el AMP. EL rompimiento o hidrólisis del ATP. | + | <center>Figura 2. Representa los componentes del Adenosín trifosfato (ATP), así como el ADP y el AMP. EL rompimiento o hidrólisis del ATP.</center> |
| + | |||
Así, en las células se establece una poza de ADP capaz de energizarse por procesos celulares como la respiración, dando origen a una poza de ATP. El ATP a su vez es capaz de hidrolizarse y liberar un fosfato y la energía correspondiente en sincronía con alguna reacción metabólica que requiera dicha energía. Podríamos decir que la síntesis del ATP es una reacción anabólica y su rompimiento es reacción catabólica (ver figura 3). | Así, en las células se establece una poza de ADP capaz de energizarse por procesos celulares como la respiración, dando origen a una poza de ATP. El ATP a su vez es capaz de hidrolizarse y liberar un fosfato y la energía correspondiente en sincronía con alguna reacción metabólica que requiera dicha energía. Podríamos decir que la síntesis del ATP es una reacción anabólica y su rompimiento es reacción catabólica (ver figura 3). | ||
| Línea 48: | Línea 46: | ||
<center>[[Archivo:Síntesis ADP-ATP.jpg]]</center> | <center>[[Archivo:Síntesis ADP-ATP.jpg]]</center> | ||
| − | Figura 3. Representa la síntesis de ATP gracias a la energía proveniente de los alimentos, así como su ulterior rompimiento a ADP más un fosfato inorgánico para proveer de energía a la célula. | + | <center>Figura 3. Representa la síntesis de ATP gracias a la energía proveniente de los alimentos, así como su ulterior rompimiento a ADP más un fosfato inorgánico para proveer de energía a la célula.</center> |
De los fenómenos metabólicos mejor conocidos, podemos mencionar como ejemplo típico de reacción catabólica a la respiración celular, ya que, durante este proceso, la glucosa se rompe en 6 moléculas de CO2 y 6 moléculas de H2O con la consiguiente producción de 36 moléculas ATP (como ganancia neta). | De los fenómenos metabólicos mejor conocidos, podemos mencionar como ejemplo típico de reacción catabólica a la respiración celular, ya que, durante este proceso, la glucosa se rompe en 6 moléculas de CO2 y 6 moléculas de H2O con la consiguiente producción de 36 moléculas ATP (como ganancia neta). | ||
| − | + | <center>[[Archivo:Gral de la resp.jpg]]</center> | |
| − | + | ||
En cuanto a reacción anabólica podemos mencionar como ejemplo típico a la fotosíntesis, ya que gracias al bióxido de carbono (constituido de tres átomos), el agua (también de tres átomos) y mediante la energía luminosa y la clorofila se genera glucosa (C6 H12 O6; es decir, un compuesto de 24 átomos), liberándose como producto de desecho O2. Desde luego, se requieren 6 moléculas de bióxido de carbono y 12 de agua (en realidad, 6 de ellas son realmente incorporadas y 6 son regeneradas al final), por lo que la reacción está balanceada en cuanto al número de átomos de cada elemento, pero es claro que la molécula de glucosa es bastante más grande que cualquiera de los dos reactivos. Otros ejemplos lo son la síntesis de proteínas o de ADN. | En cuanto a reacción anabólica podemos mencionar como ejemplo típico a la fotosíntesis, ya que gracias al bióxido de carbono (constituido de tres átomos), el agua (también de tres átomos) y mediante la energía luminosa y la clorofila se genera glucosa (C6 H12 O6; es decir, un compuesto de 24 átomos), liberándose como producto de desecho O2. Desde luego, se requieren 6 moléculas de bióxido de carbono y 12 de agua (en realidad, 6 de ellas son realmente incorporadas y 6 son regeneradas al final), por lo que la reacción está balanceada en cuanto al número de átomos de cada elemento, pero es claro que la molécula de glucosa es bastante más grande que cualquiera de los dos reactivos. Otros ejemplos lo son la síntesis de proteínas o de ADN. | ||
| − | + | <center>[[Archivo:Gral de la foto.jpg]]</center> | |
| − | + | ||
• '''Carbohidratos, Lípidos, Proteínas y Nucleótidos | • '''Carbohidratos, Lípidos, Proteínas y Nucleótidos | ||
| Línea 64: | Línea 60: | ||
Como ya hemos mencionado, existen grados de diferencia tanto entre las especies, como entre los individuos. ¿Pero a qué atribuimos tales diferencias? Desde luego que, en primer lugar a los genes, que se expresan a través de proteínas y enzimas (que también tienen naturaleza proteica), y a través del metabolismo desatado por tal actividad enzimática, y finalmente por los compuestos bioquímicos presentes. Pues bien, tales compuestos bioquímicos pertenecen a grupos muy conocidos: Carbohidratos, Lípidos, Proteínas y Nucleótidos. Pero no son los únicos, tenemos también la presencia insoslayable del agua, las sales minerales y las vitaminas. A continuación, desarrollaremos la temática correspondiente a estos compuestos, así como un ejemplo selecto de su participación en el metabolismo de diversas especies. | Como ya hemos mencionado, existen grados de diferencia tanto entre las especies, como entre los individuos. ¿Pero a qué atribuimos tales diferencias? Desde luego que, en primer lugar a los genes, que se expresan a través de proteínas y enzimas (que también tienen naturaleza proteica), y a través del metabolismo desatado por tal actividad enzimática, y finalmente por los compuestos bioquímicos presentes. Pues bien, tales compuestos bioquímicos pertenecen a grupos muy conocidos: Carbohidratos, Lípidos, Proteínas y Nucleótidos. Pero no son los únicos, tenemos también la presencia insoslayable del agua, las sales minerales y las vitaminas. A continuación, desarrollaremos la temática correspondiente a estos compuestos, así como un ejemplo selecto de su participación en el metabolismo de diversas especies. | ||
| − | + | ||
| + | EL AGUA | ||
| + | |||
El agua se encuentra formando parte de los seres vivos aproximadamente en unas tres cuartas partes de su peso corporal, aunque existen organismos que llegan a estar constituidos por agua hasta en un 99% (en el caso de las medusas) o en el otro extremo, algunos insectos que llegan a tener un 40% (ver figuras 1 – 2). | El agua se encuentra formando parte de los seres vivos aproximadamente en unas tres cuartas partes de su peso corporal, aunque existen organismos que llegan a estar constituidos por agua hasta en un 99% (en el caso de las medusas) o en el otro extremo, algunos insectos que llegan a tener un 40% (ver figuras 1 – 2). | ||
| − | <center>[[Archivo:Medusa azul.jpg]]</center> | + | <center>[[Archivo:Medusa azul.jpg|500px]]</center> |
| − | Figura 1. Las medusas llegan a estar constituidas por agua en un 99%. | + | <center>Figura 1. Las medusas llegan a estar constituidas por agua en un 99%.</center> |
| − | |||
| + | <center>[[Archivo:Saltamontes verde.jpg|500px]]</center> | ||
| + | |||
| + | <center>Figura 2. Los saltamontes pueden estar constituidos por un 40% de agua.</center> | ||
| − | |||
Funciones biológicas del agua | Funciones biológicas del agua | ||
| + | |||
1. El agua está considerada como el solvente universal. Su molécula polar permite la disolución de prácticamente todos los compuestos polares, tanto inorgánicos como orgánicos. | 1. El agua está considerada como el solvente universal. Su molécula polar permite la disolución de prácticamente todos los compuestos polares, tanto inorgánicos como orgánicos. | ||
| Línea 92: | Línea 92: | ||
7. Amortigua la temperatura planetaria. En efecto, al cubrir tres cuartas partes de la superficie terrestre, mantiene una temperatura adecuada para la vida, tanto en tierra como en las masas acuáticas, ya que la polaridad molecular del agua genera un mayor volumen al estado sólido, lo que provoca que el hielo flote y mantenga condiciones de vida bajo la costra de hielo polar. | 7. Amortigua la temperatura planetaria. En efecto, al cubrir tres cuartas partes de la superficie terrestre, mantiene una temperatura adecuada para la vida, tanto en tierra como en las masas acuáticas, ya que la polaridad molecular del agua genera un mayor volumen al estado sólido, lo que provoca que el hielo flote y mantenga condiciones de vida bajo la costra de hielo polar. | ||
| − | + | SALES MINERALES | |
| + | |||
Las sales minerales pueden encontrarse en los organismos de dos maneras principales: i) sólidas en forma de precipitado e ii) disueltas en agua, formando iones (Aniones, el ion negativo como PO43- y Cl-; y Cationes, la parte positiva de la sal como K+, Na+ o Ca+). Cumplen diversas funciones celulares como el mantenimiento de los procesos de presión osmótica y de homeostasis, auxilian en la formación y mantenimiento de los huesos, regulan la actividad enzimática y el volumen celular a través de la presión osmótica, generan potenciales eléctricos importantes para las actividades nerviosa y muscular entre otras funciones (ver figura 3). | Las sales minerales pueden encontrarse en los organismos de dos maneras principales: i) sólidas en forma de precipitado e ii) disueltas en agua, formando iones (Aniones, el ion negativo como PO43- y Cl-; y Cationes, la parte positiva de la sal como K+, Na+ o Ca+). Cumplen diversas funciones celulares como el mantenimiento de los procesos de presión osmótica y de homeostasis, auxilian en la formación y mantenimiento de los huesos, regulan la actividad enzimática y el volumen celular a través de la presión osmótica, generan potenciales eléctricos importantes para las actividades nerviosa y muscular entre otras funciones (ver figura 3). | ||
| + | <center>[[Archivo:Bomba de sodio-potasio.jpg|500px]]</center> | ||
| − | Figura 3. Bomba de sodio – potasio que genera el potencial de acción de las células nerviosas. | + | <center>Figura 3. Bomba de sodio – potasio que genera el potencial de acción de las células nerviosas.</center> |
| + | |||
Como participante de los procesos metabólicos, se sabe que algunos minerales actúan como cofactores activadores de las enzimas. A nivel intracelular, existen más de 10 000 enzimas que son necesarias para que el metabolismo funcione correctamente, y estas enzimas no pueden funcionar correctamente si sus activadores minerales no se encuentran presentes. | Como participante de los procesos metabólicos, se sabe que algunos minerales actúan como cofactores activadores de las enzimas. A nivel intracelular, existen más de 10 000 enzimas que son necesarias para que el metabolismo funcione correctamente, y estas enzimas no pueden funcionar correctamente si sus activadores minerales no se encuentran presentes. | ||
| − | + | VITAMINAS | |
| + | |||
Las vitaminas son sustancias que no tienen una estructura química homogénea, lo que tienen en común es que les son necesarias a los seres vivientes en cantidades muy bajas, del orden de miligramos o microgramos por día. Tienen funciones metabólicas importantes por actuar como, o ser precursores de coenzimas, que son factores imprescindibles para que las enzimas cumplan su función de síntesis o catálisis. | Las vitaminas son sustancias que no tienen una estructura química homogénea, lo que tienen en común es que les son necesarias a los seres vivientes en cantidades muy bajas, del orden de miligramos o microgramos por día. Tienen funciones metabólicas importantes por actuar como, o ser precursores de coenzimas, que son factores imprescindibles para que las enzimas cumplan su función de síntesis o catálisis. | ||
| − | |||
| + | Por su afinidad de solubilidad, las vitaminas pueden ser solubles en agua o en lípidos, como se puede ver en la tabla 1, que además presenta los daños provocados por su carencia: | ||
| − | Tabla 1. Presenta las diversas vitaminas, su solubilidad en agua o en grasas, así como los daños que provocan se carencia y su exceso. | + | <center>Tabla 1. Presenta las diversas vitaminas, su solubilidad en agua o en grasas, así como los daños que provocan se carencia y su exceso.</center> |
| + | <center>[[Archivo:Tabla de vitaminas.jpg]]</center> | ||
| + | CARBOHIDRATOS | ||
| − | |||
Los carbohidratos, también llamados hidratos de carbono o glúcidos son macromoléculas formadas casi exclusivamente de carbono, hidrógeno y oxígeno, por lo que se les llama compuestos terciarios, (ya que tienen tres de los cuatro elementos biogenéticos: CHON) en donde el hidrógeno y el oxígeno se encuentran generalmente en la misma proporción que el agua por cada carbono presente (CH2O)n, de ahí que se les denominara carbohidratos (de carbo, carbono e hidro, agua) aunque hoy en día se sabe que existen carbohidratos como la desoxirribosa (C5H10O4) en los que el hidrógeno y el oxígeno no guardan esa proporción. | Los carbohidratos, también llamados hidratos de carbono o glúcidos son macromoléculas formadas casi exclusivamente de carbono, hidrógeno y oxígeno, por lo que se les llama compuestos terciarios, (ya que tienen tres de los cuatro elementos biogenéticos: CHON) en donde el hidrógeno y el oxígeno se encuentran generalmente en la misma proporción que el agua por cada carbono presente (CH2O)n, de ahí que se les denominara carbohidratos (de carbo, carbono e hidro, agua) aunque hoy en día se sabe que existen carbohidratos como la desoxirribosa (C5H10O4) en los que el hidrógeno y el oxígeno no guardan esa proporción. | ||
| Línea 117: | Línea 122: | ||
Entre los monosacáridos más conocidos se encuentran la glucosa (ver figura 4) y la fructosa, que son los más abundantes en la naturaleza y cuyo origen está en la fotosíntesis de los vegetales; está también la galactosa, así como la ribosa y la desoxirribosa presentes en los ácidos ribo y desoxirribonucleico (RNA y DNA), respectivamente. La glucosa, de donde se deriva el término glúcido, tiene gran importancia fisiológica en los mamíferos, ya que se requiere determinada concentración de este monosacárido en la sangre (72-145 miligramos por decilitro), de otro modo se presentan diversos problemas. Una concentración más baja (hipoglucemia), puede provocar visión doble, irritabilidad, confusión, e incluso desmayos y convulsiones; esta situación puede presentarse en personas privadas de alimentos, con dietas rigurosas o en personas con problemas de diabetes. Por lo contrario, una concentración elevada (hiperglucemia o diabetes), puede generar sed, visión borrosa, piel seca y necesidad de orinar con frecuencia. De hecho, el organismo fabrica una hormona, la insulina, para controlar los niveles de glucosa en la sangre. | Entre los monosacáridos más conocidos se encuentran la glucosa (ver figura 4) y la fructosa, que son los más abundantes en la naturaleza y cuyo origen está en la fotosíntesis de los vegetales; está también la galactosa, así como la ribosa y la desoxirribosa presentes en los ácidos ribo y desoxirribonucleico (RNA y DNA), respectivamente. La glucosa, de donde se deriva el término glúcido, tiene gran importancia fisiológica en los mamíferos, ya que se requiere determinada concentración de este monosacárido en la sangre (72-145 miligramos por decilitro), de otro modo se presentan diversos problemas. Una concentración más baja (hipoglucemia), puede provocar visión doble, irritabilidad, confusión, e incluso desmayos y convulsiones; esta situación puede presentarse en personas privadas de alimentos, con dietas rigurosas o en personas con problemas de diabetes. Por lo contrario, una concentración elevada (hiperglucemia o diabetes), puede generar sed, visión borrosa, piel seca y necesidad de orinar con frecuencia. De hecho, el organismo fabrica una hormona, la insulina, para controlar los niveles de glucosa en la sangre. | ||
| + | |||
| + | <center>[[Archivo:Cicloglucosa.jpg]]</center> | ||
| + | |||
| + | <center>Figura 4. Fórmulas lineal y cíclica de la glucosa. Esta molécula, por ser tan larga, puede plegarse y, espontáneamente formar enlaces entre los carbonos 1 y 5 mediante un puente de oxígeno.</center> | ||
| − | |||
Los disacáridos son carbohidratos formados por la unión de dos monosacáridos, los enlaces que unen a los dos monosacáridos se llaman enlaces glucosídicos, que se forman por el desprendimiento de una molécula de agua de los dos grupos hidroxilo (−OH) contiguos, quedando como enlace un puente de oxígeno que une a dos carbonos de los monosacáridos vecinos. | Los disacáridos son carbohidratos formados por la unión de dos monosacáridos, los enlaces que unen a los dos monosacáridos se llaman enlaces glucosídicos, que se forman por el desprendimiento de una molécula de agua de los dos grupos hidroxilo (−OH) contiguos, quedando como enlace un puente de oxígeno que une a dos carbonos de los monosacáridos vecinos. | ||
Entre los disacáridos más conocidos se encuentra la sacarosa o azúcar de mesa (ver figura 5), que se extrae de la caña de azúcar y de la remolacha; otro disacárido común es la lactosa que se encuentra presente en la leche, además de la maltosa que es empleada para la elaboración de cerveza. | Entre los disacáridos más conocidos se encuentra la sacarosa o azúcar de mesa (ver figura 5), que se extrae de la caña de azúcar y de la remolacha; otro disacárido común es la lactosa que se encuentra presente en la leche, además de la maltosa que es empleada para la elaboración de cerveza. | ||
| + | <center>[[Archivo:Sacarosa.jpg]]</center> | ||
| − | Figura 5. La sacarosa o azúcar común, disacárido constituido por la unión de los monosacáridos glucosa y fructosa por un enlace glucosídico. | + | <center>Figura 5. La sacarosa o azúcar común, disacárido constituido por la unión de los monosacáridos glucosa y fructosa por un enlace glucosídico.</center> |
| + | |||
| + | |||
Los oligosacáridos se forman por la unión de entre tres y nueve monosacáridos, con la liberación de una molécula de agua por cada enlace. Un trisacárido muy conocido es un componente común de cacahuates y algunas leguminosas (frijol, soya, garbanzos y chícharos), la rafinosa, que se conforma por la unión de glucosa, fructosa y galactosa. Otros oligosacáridos de mayor peso molecular constituyen glucolípidos o glucoproteínas al asociarse a lípidos o a proteínas. Son importantes constituyentes del glucocálix celular y tienen funciones de señalización y reconocimiento celular. | Los oligosacáridos se forman por la unión de entre tres y nueve monosacáridos, con la liberación de una molécula de agua por cada enlace. Un trisacárido muy conocido es un componente común de cacahuates y algunas leguminosas (frijol, soya, garbanzos y chícharos), la rafinosa, que se conforma por la unión de glucosa, fructosa y galactosa. Otros oligosacáridos de mayor peso molecular constituyen glucolípidos o glucoproteínas al asociarse a lípidos o a proteínas. Son importantes constituyentes del glucocálix celular y tienen funciones de señalización y reconocimiento celular. | ||
| + | |||
Los polisacáridos son largas cadenas formadas por la unión de muchos monosacáridos mediante enlaces glucosídicos y que además pueden formar ramificaciones de las cadenas, dando origen a moléculas extremadamente grandes y de un elevado peso molecular. Ejemplos de estos compuestos son: el almidón (ver figura 6), la celulosa y la quitina. | Los polisacáridos son largas cadenas formadas por la unión de muchos monosacáridos mediante enlaces glucosídicos y que además pueden formar ramificaciones de las cadenas, dando origen a moléculas extremadamente grandes y de un elevado peso molecular. Ejemplos de estos compuestos son: el almidón (ver figura 6), la celulosa y la quitina. | ||
| + | <center>[[Archivo:Cadena de almidón.jpg]]</center> | ||
| − | Figura 6. Ejemplo de encadenamiento de moléculas de glucosa para constituir al polisacárido denominado almidón. | + | <center>Figura 6. Ejemplo de encadenamiento de moléculas de glucosa para constituir al polisacárido denominado almidón.</center> |
| + | |||
Los polisacáridos tienen dos funciones dentro de la fisiología de las células, una como fuente de energía que las células utilizan y almacenan con bastante eficiencia como el almidón en las plantas y el glucógeno en los animales; de estos carbohidratos los organismos obtienen la energía para sus procesos vitales. La otra función de los polisacáridos es como elementos extracelulares estructurales, como la celulosa y la quitina, la primera refuerza las paredes de las células vegetales y la quitina da rigidez al exoesqueleto de muchos animales, como los caparazones de los artrópodos. | Los polisacáridos tienen dos funciones dentro de la fisiología de las células, una como fuente de energía que las células utilizan y almacenan con bastante eficiencia como el almidón en las plantas y el glucógeno en los animales; de estos carbohidratos los organismos obtienen la energía para sus procesos vitales. La otra función de los polisacáridos es como elementos extracelulares estructurales, como la celulosa y la quitina, la primera refuerza las paredes de las células vegetales y la quitina da rigidez al exoesqueleto de muchos animales, como los caparazones de los artrópodos. | ||
| − | + | ||
| − | A los lípidos también se les conoce comúnmente con el nombre de grasas y aceites. Los lípidos no son solubles en agua, sino en los llamados solventes orgánicos como el alcohol y la acetona. Constan principalmente de átomos de carbono, hidrógeno y oxígeno (aunque a diferencia de los carbohidratos, tienen mayor cantidad de átomos de hidrógeno y menor cantidad de oxígeno), por lo que hay mayor cantidad de enlaces C−H que son muy ricos en energía. Por eso las grasas proporcionan más del doble de calorías por gramo que los carbohidratos. | + | LÍPIDOS |
| − | + | ||
| − | + | A los lípidos también se les conoce comúnmente con el nombre de grasas y aceites. Los lípidos no son solubles en agua, sino en los llamados solventes orgánicos como el alcohol y la acetona. Constan principalmente de átomos de carbono, hidrógeno y oxígeno (aunque a diferencia de los carbohidratos, tienen mayor cantidad de átomos de hidrógeno y menor cantidad de oxígeno), por lo que hay mayor cantidad de enlaces C−H que son muy ricos en energía. Por eso las grasas proporcionan más del doble de calorías por gramo que los carbohidratos. | |
| − | + | <center>[[Archivo:Kcal por gr.jpg]]</center> | |
| + | |||
Químicamente, los lípidos o grasas son un grupo heterogéneo que tienen en común la presencia de dos componentes fundamentales: glicerol y ácidos grasos. El glicerol (ver figura 7), está formado por tres carbonos hidroxilados a la manera de los azúcares, mientras que los ácidos grasos (ver figura 8), son cadenas de hasta 18 átomos de carbono a los que se encuentran unidos los átomos de hidrógeno y en el extremo de la cadena un grupo carboxilo (−COOH). Una molécula de glicerol se combina con tres moléculas de ácidos grasos para formar una grasa (de ahí el término más técnico de triglicéridos o grasas neutras) (ver figura 9). De ácidos grasos se tienen identificados alrededor de 40. | Químicamente, los lípidos o grasas son un grupo heterogéneo que tienen en común la presencia de dos componentes fundamentales: glicerol y ácidos grasos. El glicerol (ver figura 7), está formado por tres carbonos hidroxilados a la manera de los azúcares, mientras que los ácidos grasos (ver figura 8), son cadenas de hasta 18 átomos de carbono a los que se encuentran unidos los átomos de hidrógeno y en el extremo de la cadena un grupo carboxilo (−COOH). Una molécula de glicerol se combina con tres moléculas de ácidos grasos para formar una grasa (de ahí el término más técnico de triglicéridos o grasas neutras) (ver figura 9). De ácidos grasos se tienen identificados alrededor de 40. | ||
| − | + | <center>[[Archivo:Glicerol AVB.jpg|200px]]]</center> | |
| − | + | ||
| + | <center>Figura 7. El glicerol, también llamado propanotriol por ser un derivado trihidroxilado (con tres grupos –OH) del propano.</center> | ||
| + | |||
| + | <center>[[Archivo:Ácidos grasos AVB.jpg]]</center> | ||
| − | Figura 8. Los ácidos grasos son largas cadenas de carbono que pueden estar saturadas o no con hidrógeno y que además poseen un grupo ácido (-COOH). | + | <center>Figura 8. Los ácidos grasos son largas cadenas de carbono que pueden estar saturadas o no con hidrógeno y que además poseen un grupo ácido (-COOH).</center> |
| + | |||
Los ácidos grasos se clasifican comúnmente como saturados e insaturados, dependiendo de la presencia de enlaces sencillos, dobles o triples entre carbonos vecinos (ver figura 8). Los que solo presentan enlaces sencillos entre carbonos vecinos se denominan saturados (normalmente las grasas animales) y los ácidos grasos que presentan enlaces dobles y/o triples entre carbonos vecinos (normalmente las grasa vegetales), se denominan insaturados o poliinsaturados. Generalmente las grasas animales con ácidos grasos de cadenas largas son sólidas (como la manteca) mientras que las grasas vegetales (aceites de semillas) son líquidas a temperatura ambiente. | Los ácidos grasos se clasifican comúnmente como saturados e insaturados, dependiendo de la presencia de enlaces sencillos, dobles o triples entre carbonos vecinos (ver figura 8). Los que solo presentan enlaces sencillos entre carbonos vecinos se denominan saturados (normalmente las grasas animales) y los ácidos grasos que presentan enlaces dobles y/o triples entre carbonos vecinos (normalmente las grasa vegetales), se denominan insaturados o poliinsaturados. Generalmente las grasas animales con ácidos grasos de cadenas largas son sólidas (como la manteca) mientras que las grasas vegetales (aceites de semillas) son líquidas a temperatura ambiente. | ||
| + | <center>[[Archivo:Triglicéridos AVB.jpg]]</center> | ||
| − | Figura 9. La unión entre un glicerol y tres ácidos grasos iguales o disímiles dan origen a un triglicérido. En la imagen, R = radical (cadena de carbonos saturada o no, como las representadas en la fig. anterior 8). | + | <center>Figura 9. La unión entre un glicerol y tres ácidos grasos iguales o disímiles dan origen a un triglicérido. En la imagen, R = radical (cadena de carbonos saturada o no, como las representadas en la fig. anterior 8).</center> |
| + | |||
Hay lípidos que no contienen ácidos grasos como componentes, como son los terpenos y los esteroides, ambos de gran importancia para los organismos animales, incluido el hombre. Los terpenos incluyen ciertas vitaminas liposolubles como las vitaminas A, E y K (ver figura 10), así como algunos carotenoides, que son pigmentos de color amarillo a naranja que participan en la fotosíntesis de las células vegetales. Los terpenos son componentes que determinan los aromas y sabores de las plantas, como el mentol, el eucaliptol, el olor de los limones y de los geranios. | Hay lípidos que no contienen ácidos grasos como componentes, como son los terpenos y los esteroides, ambos de gran importancia para los organismos animales, incluido el hombre. Los terpenos incluyen ciertas vitaminas liposolubles como las vitaminas A, E y K (ver figura 10), así como algunos carotenoides, que son pigmentos de color amarillo a naranja que participan en la fotosíntesis de las células vegetales. Los terpenos son componentes que determinan los aromas y sabores de las plantas, como el mentol, el eucaliptol, el olor de los limones y de los geranios. | ||
| + | |||
Por su parte, los esteroides son un grupo especialmente importante de lípidos, ya que tiene propiedades fisiológicas determinantes para los humanos, a este grupo pertenecen la hormona masculina (testosterona), y las hormonas femeninas (estrógeno y progesterona), también la vitamina D y el colesterol, este último a pesar de su mala fama por estar ligado a la acumulación de lípidos en las arterias, lo que constituye la arterioesclerosis, es importante por formar parte de todas las membranas celulares y por ser precursor de la formación de varias hormonas. | Por su parte, los esteroides son un grupo especialmente importante de lípidos, ya que tiene propiedades fisiológicas determinantes para los humanos, a este grupo pertenecen la hormona masculina (testosterona), y las hormonas femeninas (estrógeno y progesterona), también la vitamina D y el colesterol, este último a pesar de su mala fama por estar ligado a la acumulación de lípidos en las arterias, lo que constituye la arterioesclerosis, es importante por formar parte de todas las membranas celulares y por ser precursor de la formación de varias hormonas. | ||
| + | <center>[[Archivo:Vitaminas terpenoides AVB.jpg]]</center> | ||
| − | Figura 10. Ejemplo de dos vitaminas terpenoides. | + | <center>Figura 10. Ejemplo de dos vitaminas terpenoides.</center> |
| + | |||
| + | |||
Además de las ya mencionadas, los lípidos en el organismo tienen dos importantes funciones, son parte de la estructura de todas las células formando parte de las membranas celulares (fosfolípidos) y constituyen una fuente de energía y material de reserva que se acumula bajo la piel de los animales y en semillas y frutos de algunos vegetales. | Además de las ya mencionadas, los lípidos en el organismo tienen dos importantes funciones, son parte de la estructura de todas las células formando parte de las membranas celulares (fosfolípidos) y constituyen una fuente de energía y material de reserva que se acumula bajo la piel de los animales y en semillas y frutos de algunos vegetales. | ||
| − | + | ||
| + | PROTEINAS | ||
| + | |||
Dentro de las macromoléculas, las proteínas son moléculas excepcionalmente grandes, diversas y complejas, y son los compuestos orgánicos más abundantes en los animales, al igual que en las plantas las moléculas más abundantes son los carbohidratos. | Dentro de las macromoléculas, las proteínas son moléculas excepcionalmente grandes, diversas y complejas, y son los compuestos orgánicos más abundantes en los animales, al igual que en las plantas las moléculas más abundantes son los carbohidratos. | ||
Químicamente las proteínas están constituidas por átomos de carbono, hidrógeno, oxígeno y nitrógeno (CHON) por lo que reciben el nombre de elementos cuaternarios, aunque las hay que pueden también contener azufre o fósforo. Estos elementos se organizan en unidades denominadas aminoácidos, de los cuales existen 20 diferentes, los cuales varían en cuanto a su tamaño molecular, pero todos contienen uno o más grupos amino (−NH2) y uno o más grupos carboxilo (−COOH), unidos en una cadena de átomos de carbono mediante enlaces llamados peptídicos que se forman al perderse una molécula de agua entre dos aminoácidos contiguos (ver tabla 2). | Químicamente las proteínas están constituidas por átomos de carbono, hidrógeno, oxígeno y nitrógeno (CHON) por lo que reciben el nombre de elementos cuaternarios, aunque las hay que pueden también contener azufre o fósforo. Estos elementos se organizan en unidades denominadas aminoácidos, de los cuales existen 20 diferentes, los cuales varían en cuanto a su tamaño molecular, pero todos contienen uno o más grupos amino (−NH2) y uno o más grupos carboxilo (−COOH), unidos en una cadena de átomos de carbono mediante enlaces llamados peptídicos que se forman al perderse una molécula de agua entre dos aminoácidos contiguos (ver tabla 2). | ||
| − | |||
| − | + | <center>Tabla 2. Presenta el nombre de cada uno de los 20 aminoácidos, 10 de ellos escritos en cursivas por ser aminoácidos esenciales (los otros 10 son no esenciales); en la segunda columna se presenta su abreviatura y en la tercera, el número de grupos amino y ácido presentes (Los monoamino, monocarboxílicos presentan asterisco *), así como los de estructura cíclica.</center> | |
| − | + | ||
| − | + | ||
| − | + | <center>[[Archivo:Lista de aminoácidos AVB.jpg]]</center> | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
Las proteínas existentes en la naturaleza son largas cadenas de aminoácidos enlazados que contienen entre 50 y 150 000 aminoácidos, y cada uno de estos aminoácidos ocupa en la cadena un lugar exacto, de acuerdo con la fórmula que cada proteína tiene, un solo cambio en la posición de un aminoácido puede inactivar a la proteína. La secuencia de los aminoácidos en la proteína es la que determina la función de ésta: si es una proteína estructural, una enzima o una hormona. | Las proteínas existentes en la naturaleza son largas cadenas de aminoácidos enlazados que contienen entre 50 y 150 000 aminoácidos, y cada uno de estos aminoácidos ocupa en la cadena un lugar exacto, de acuerdo con la fórmula que cada proteína tiene, un solo cambio en la posición de un aminoácido puede inactivar a la proteína. La secuencia de los aminoácidos en la proteína es la que determina la función de ésta: si es una proteína estructural, una enzima o una hormona. | ||
| + | |||
La principal función de las proteínas en el cuerpo de los animales es de tipo estructural, ya que forman los músculos, el pelo, la piel, las uñas, los cartílagos y los huesos, constituyendo más de la mitad del peso seco de las células (ver figura 11). También son fuente de energía pues contienen una cantidad importante de átomos de hidrógeno. | La principal función de las proteínas en el cuerpo de los animales es de tipo estructural, ya que forman los músculos, el pelo, la piel, las uñas, los cartílagos y los huesos, constituyendo más de la mitad del peso seco de las células (ver figura 11). También son fuente de energía pues contienen una cantidad importante de átomos de hidrógeno. | ||
| + | <center>[[Archivo:Plumas guacamayo.jpg|500px]]</center> | ||
| − | Figura 11. Los colores en el plumaje de las aves, puede deberse a pigmentos proteicos allí presentes o a efectos de la luz sobre la proteína queratina que constituye a las plumas. | + | <center>Figura 11. Los colores en el plumaje de las aves, puede deberse a pigmentos proteicos allí presentes o a efectos de la luz sobre la proteína queratina que constituye a las plumas.</center> |
| + | |||
Un grupo muy especial de proteínas son las hormonas (ver figura 12); Otro grupo de proteínas da origen a las enzimas, que funcionan como biocatalizadores de las reacciones químicas que se producen en las células. La variedad de enzimas es impresionante ya que cada una de ellas es específica para una determinada reacción y en nuestro organismo se efectúan más de 100,000 reacciones químicas diferentes (ver figura 13). y un tercer grupo constituye los anticuerpos para la defensa del organismo frente a infecciones de virus y bacterias. | Un grupo muy especial de proteínas son las hormonas (ver figura 12); Otro grupo de proteínas da origen a las enzimas, que funcionan como biocatalizadores de las reacciones químicas que se producen en las células. La variedad de enzimas es impresionante ya que cada una de ellas es específica para una determinada reacción y en nuestro organismo se efectúan más de 100,000 reacciones químicas diferentes (ver figura 13). y un tercer grupo constituye los anticuerpos para la defensa del organismo frente a infecciones de virus y bacterias. | ||
| − | + | <center>[[Archivo:Hormonas AVB.jpg|500px]]</center> | |
| + | <center>Figura 12. Algunas hormonas, sus lugares de síntesis y de acción.</center> | ||
| − | |||
| + | <center>[[Archivo:Mamífero AVB.jpg|500px]]</center> | ||
| + | <center>Figura 13. Los mamíferos sintetizamos la enzima lactasa, que digiere a la lactosa o azúcar de la leche.</center> | ||
| − | |||
| − | |||
Aunque la dieta animal incluye normalmente proteínas, estas son rotas en sus aminoácidos constituyentes durante el proceso digestivo. Dichos aminoácidos son asimilados en el intestino y llevados a cada célula, donde bajo las órdenes del DNA son reorganizados en nuevas proteínas específicas de cada especie e individuo. | Aunque la dieta animal incluye normalmente proteínas, estas son rotas en sus aminoácidos constituyentes durante el proceso digestivo. Dichos aminoácidos son asimilados en el intestino y llevados a cada célula, donde bajo las órdenes del DNA son reorganizados en nuevas proteínas específicas de cada especie e individuo. | ||
| − | + | ||
| + | NUCLEOTIDOS | ||
| + | |||
Los nucleótidos son compuestos que contienen CHONP, por lo que exceden lo cuaternario, y se constituyen de tres grupos de compuestos: un azúcar pentosa (con 5 carbonos), una base nitrogenada y un grupo fosfato. Existen dos tipos de nucleótidos, uno, en los que el azúcar es la ribosa y forman el ácido ribonucleico (RNA) y otros en los que el azúcar es la desoxirribosa y forman el ácido desoxirribonucleico (DNA). | Los nucleótidos son compuestos que contienen CHONP, por lo que exceden lo cuaternario, y se constituyen de tres grupos de compuestos: un azúcar pentosa (con 5 carbonos), una base nitrogenada y un grupo fosfato. Existen dos tipos de nucleótidos, uno, en los que el azúcar es la ribosa y forman el ácido ribonucleico (RNA) y otros en los que el azúcar es la desoxirribosa y forman el ácido desoxirribonucleico (DNA). | ||
| + | |||
La otra estructura diferencial de los nucleótidos son las bases nitrogenadas, que pueden ser de dos tipos: púricas como la adenina y la guanina, y pirimídicas como la timina, la citosina y el uracilo. El DNA contiene la adenina (A), la guanina (G), la citosina (C) y la timina (T); el RNA tiene la adenina, guanina y citosina, pero la timina cambia por el uracilo (U). | La otra estructura diferencial de los nucleótidos son las bases nitrogenadas, que pueden ser de dos tipos: púricas como la adenina y la guanina, y pirimídicas como la timina, la citosina y el uracilo. El DNA contiene la adenina (A), la guanina (G), la citosina (C) y la timina (T); el RNA tiene la adenina, guanina y citosina, pero la timina cambia por el uracilo (U). | ||
| − | Los grupos fosfato y las unidades de azúcar de los nucleótidos se alternan entre sí para formar dos largas cadenas que se enrollan entre sí formando la doble columna de la molécula de DNA que se conoce como doble hélice. Las dos cadenas de nucleótidos de la hélice se unen entre sí a través del eje mediante el apareamiento de las bases nitrogenadas (ver tabla 3). | + | Los grupos fosfato y las unidades de azúcar de los nucleótidos se alternan entre sí para formar dos largas cadenas que se enrollan entre sí formando la doble columna de la molécula de DNA que se conoce como doble hélice. Las dos cadenas de nucleótidos de la hélice se unen entre sí a través del eje mediante el apareamiento de las bases nitrogenadas (ver tabla 3). |
| − | Tabla 3. Presenta los componentes de los nucleótidos. La ribosa y el uracilo, marcados con asterisco, son constituyentes exclusivos del RNA (ácido ribonucleico), mientras que la desoxirribosa y la timina, escritos con cursivas son constituyentes exclusivos del DNA (ácido desoxirribonucleico) | + | |
| + | <center>Tabla 3. Presenta los componentes de los nucleótidos. La ribosa y el uracilo, marcados con asterisco, son constituyentes exclusivos del RNA (ácido ribonucleico), mientras que la desoxirribosa y la timina, escritos con cursivas son constituyentes exclusivos del DNA (ácido desoxirribonucleico)</center> | ||
| + | |||
| + | |||
| + | <center>[[Archivo:Tabla nucleotidos.jpg]]</center> | ||
Químicamente, el fosfato podemos considerarlo derivado del ácido fosfórico, H3PO4. Su estructura se puede ver en la figura 14. | Químicamente, el fosfato podemos considerarlo derivado del ácido fosfórico, H3PO4. Su estructura se puede ver en la figura 14. | ||
| + | <center>[[Archivo:Fosfato LAVB.jpg]]</center> | ||
| − | Figura 14. Representación química del grupo fosfato. Se entiende que los dos átomos de oxígeno con carga negativa sirven para establecer enlaces covalentes con los azúcares pentosas. | + | <center>Figura 14. Representación química del grupo fosfato. Se entiende que los dos átomos de oxígeno con carga negativa sirven para establecer enlaces covalentes con los azúcares pentosas.</center> |
| + | |||
| + | |||
Por su parte los azúcares de 5 carbonos, ribosa y desoxirribosa pueden formar estructuras cíclicas en forma de pentágono, tal como se presenta en la figura 15. | Por su parte los azúcares de 5 carbonos, ribosa y desoxirribosa pueden formar estructuras cíclicas en forma de pentágono, tal como se presenta en la figura 15. | ||
| − | Figura 15. Fórmulas de ribosa y desoxirribosa. Los grupos que las diferencian están marcados con rojo. Nótese que solo difieren en un grupo oxhidrilo. | + | <center>[[Archivo:Ribo y desoxi AVB.jpg]]</center> |
| + | |||
| + | <center>Figura 15. Fórmulas de ribosa y desoxirribosa. Los grupos que las diferencian están marcados con rojo. Nótese que solo difieren en un grupo oxhidrilo.</center> | ||
| + | |||
| + | |||
Por su parte, las bases nitrogenadas constituyen los componentes más complejos, ya que las purinas presentan doble estructura cíclica, mientras que las pirimidinas presentan solo una. Las diferencias entre las cinco bases nitrogenadas se pueden constatar en la figura 16; mientras que el ensamblaje de los nucleótidos puede observarse en la figura 17. | Por su parte, las bases nitrogenadas constituyen los componentes más complejos, ya que las purinas presentan doble estructura cíclica, mientras que las pirimidinas presentan solo una. Las diferencias entre las cinco bases nitrogenadas se pueden constatar en la figura 16; mientras que el ensamblaje de los nucleótidos puede observarse en la figura 17. | ||
| + | <center>[[Archivo:Bases nitro AVB.jpg]]</center> | ||
| + | |||
| + | <center>Figura 16. Fórmulas de las cinco bases nitrogenadas. Los enlaces con las pentosas se realizan mediante un enlace covalente entre el nitrógeno señalado con asterisco en las bases y el carbono 5 del azúcar correspondiente.</center> | ||
| − | + | <center>[[Archivo:Puri piri AVB.jpg]]</center> | |
| − | + | ||
| − | Figura 17. Los nucleótidos ya ensamblados con sus tres componentes, fosfato, ribosa y base nitrogenada. En el esquema de la izquierda se presenta un nucleótido de pirimidina, en este caso, de timina; a la derecha se presenta un nucleótido de purina, en este caso, de adenina. | + | <center>Figura 17. Los nucleótidos ya ensamblados con sus tres componentes, fosfato, ribosa y base nitrogenada. En el esquema de la izquierda se presenta un nucleótido de pirimidina, en este caso, de timina; a la derecha se presenta un nucleótido de purina, en este caso, de adenina.</center> |
| + | |||
| + | |||
Los nucleótidos tienen gran importancia metabólica, no únicamente como componentes estructurales de los ácidos nucleicos, sino por que son capaces de formar compuestos trifosforilados (como el trifosfato de adenosina o ATP), capaces de almacenar cantidades considerables de energía en sus enlaces, sobre todo entre el segundo y el tercer fosfato. Esto los privilegia como transportadores de energía en el interior celular. Originándose principalmente durante los procesos energéticos como la respiración y la fotosíntesis, se utilizan en cantidad de reacciones de síntesis como la propia replicación del DNA o la síntesis proteica. | Los nucleótidos tienen gran importancia metabólica, no únicamente como componentes estructurales de los ácidos nucleicos, sino por que son capaces de formar compuestos trifosforilados (como el trifosfato de adenosina o ATP), capaces de almacenar cantidades considerables de energía en sus enlaces, sobre todo entre el segundo y el tercer fosfato. Esto los privilegia como transportadores de energía en el interior celular. Originándose principalmente durante los procesos energéticos como la respiración y la fotosíntesis, se utilizan en cantidad de reacciones de síntesis como la propia replicación del DNA o la síntesis proteica. | ||
| − | • Enzimas | + | |
| + | |||
| + | • '''Enzimas''' | ||
| + | |||
Una característica de los seres vivos es su capacidad para llevar a cabo reacciones químicas a gran velocidad a temperatura ambiente. Si estas mismas reacciones se realizaran fuera de la célula (in Vitro) lo harían muy lentamente. | Una característica de los seres vivos es su capacidad para llevar a cabo reacciones químicas a gran velocidad a temperatura ambiente. Si estas mismas reacciones se realizaran fuera de la célula (in Vitro) lo harían muy lentamente. | ||
La mayoría de las reacciones químicas solamente se realizan a temperaturas elevadas y, como todos los sistemas vivos requieren de un número muy elevado de reacciones químicas para mantenerse como tales y al mismo tiempo no soportan la elevada temperatura (principalmente porque se desnaturalizan sus proteínas), la única manera de realizarlas es mediante el uso de enzimas. Las enzimas son un tipo de proteínas sintetizadas por los seres vivos que catalizan (aceleran o retardan) una reacción química termodinámicamente posible. | La mayoría de las reacciones químicas solamente se realizan a temperaturas elevadas y, como todos los sistemas vivos requieren de un número muy elevado de reacciones químicas para mantenerse como tales y al mismo tiempo no soportan la elevada temperatura (principalmente porque se desnaturalizan sus proteínas), la única manera de realizarlas es mediante el uso de enzimas. Las enzimas son un tipo de proteínas sintetizadas por los seres vivos que catalizan (aceleran o retardan) una reacción química termodinámicamente posible. | ||
| + | |||
Las enzimas pueden trabajar en concentraciones muy bajas, y eso representa una ventaja para los sistemas vivos, ya que normalmente no requieren de una alta concentración de ellas para catalizar sus vitales reacciones químicas. Sin embargo, su naturaleza proteica les confiere especificidad, lo que quiere decir que solamente catalizan un tipo de reacción, por lo que se necesita de miles de enzimas diferentes para poder realizar todas sus reacciones. Por su misma naturaleza proteica se ven afectadas en su actividad catalítica por la acción del pH, el calor, y disolventes orgánicos que pueden desnaturalizarlas. | Las enzimas pueden trabajar en concentraciones muy bajas, y eso representa una ventaja para los sistemas vivos, ya que normalmente no requieren de una alta concentración de ellas para catalizar sus vitales reacciones químicas. Sin embargo, su naturaleza proteica les confiere especificidad, lo que quiere decir que solamente catalizan un tipo de reacción, por lo que se necesita de miles de enzimas diferentes para poder realizar todas sus reacciones. Por su misma naturaleza proteica se ven afectadas en su actividad catalítica por la acción del pH, el calor, y disolventes orgánicos que pueden desnaturalizarlas. | ||
Clasificación. Las enzimas se pueden clasificar de diferentes maneras, pero la clasificación internacional se puede ver en el cuadro 1. | Clasificación. Las enzimas se pueden clasificar de diferentes maneras, pero la clasificación internacional se puede ver en el cuadro 1. | ||
| + | <center>Cuadro 1. Clasificación de las enzimas.</center> | ||
| − | + | <center>[[Archivo:Clasif. enzimas AVB.jpg|500px]]</center> | |
| − | + | ||
| − | + | 1. Enzimas oxidorreductasas. Intervienen en los procesos de oxidación fisiológica. Estas enzimas emplean como aceptores de hidrógeno a los nucleótidos de piridina NAD (nicotinamida adenina dinucleótido), al NADP (nicotinamida adenina dinucleótido fosfato), al FAD (flavina adenina dinucleótido) o al O2. | |
| − | + | ||
| − | + | ||
| − | |||
2. Transferasas. Se encargan de catalizar la transferencia de grupos químicos de un sustrato a otro. Un ejemplo de este tipo de enzimas es la transaminasa, que transfiere grupos amino de una molécula a otra. | 2. Transferasas. Se encargan de catalizar la transferencia de grupos químicos de un sustrato a otro. Un ejemplo de este tipo de enzimas es la transaminasa, que transfiere grupos amino de una molécula a otra. | ||
| + | |||
3. Hidrolasas. Catalizan reacciones hidrolíticas y entre ellas se encuentran las enzimas digestivas como la amilasa, sacarasa, lipasa y proteasa. | 3. Hidrolasas. Catalizan reacciones hidrolíticas y entre ellas se encuentran las enzimas digestivas como la amilasa, sacarasa, lipasa y proteasa. | ||
| + | |||
4. Liasas. Son enzimas que rompen ligaduras entre carbonos, entre carbono y oxígeno y entre carbono y nitrógeno además de otros enlaces por medios diferentes a la hidrólisis y a la oxidación. En las reacciones de las liasas intervienen numerosas coenzimas. | 4. Liasas. Son enzimas que rompen ligaduras entre carbonos, entre carbono y oxígeno y entre carbono y nitrógeno además de otros enlaces por medios diferentes a la hidrólisis y a la oxidación. En las reacciones de las liasas intervienen numerosas coenzimas. | ||
| + | |||
5. Isomerasas. Catalizan reacciones en las que una molécula sustrato se convierte en un isómero. | 5. Isomerasas. Catalizan reacciones en las que una molécula sustrato se convierte en un isómero. | ||
| + | |||
6. Ligasas. Catalizan la unión de dos moléculas, utilizando energía del ATP. | 6. Ligasas. Catalizan la unión de dos moléculas, utilizando energía del ATP. | ||
Nomenclatura. Para darle nombre a una enzima, se utiliza el nombre del sustrato sobre el que actúa, añadiendo el sufijo asa. Por ejemplo; la amilasa que actúa sobre el almidón, las lipasas que actúan sobre los lípidos y las proteasas que actúan sobre las proteínas. En algunos casos se les ha dado nombre en épocas un tanto remotas que no siguen esta nomenclatura, pero que son generalmente empleados, como en el caso de la pepsina y tripsina (enzimas digestivas), por lo cual se ha establecido una nomenclatura y clasificación sistemática por parte de la International Enzyme Comission, que se emplea más en las publicaciones científicas, o cuando se requiere de una identificación exacta. Para el uso común es más práctica la nomenclatura primeramente descrita. | Nomenclatura. Para darle nombre a una enzima, se utiliza el nombre del sustrato sobre el que actúa, añadiendo el sufijo asa. Por ejemplo; la amilasa que actúa sobre el almidón, las lipasas que actúan sobre los lípidos y las proteasas que actúan sobre las proteínas. En algunos casos se les ha dado nombre en épocas un tanto remotas que no siguen esta nomenclatura, pero que son generalmente empleados, como en el caso de la pepsina y tripsina (enzimas digestivas), por lo cual se ha establecido una nomenclatura y clasificación sistemática por parte de la International Enzyme Comission, que se emplea más en las publicaciones científicas, o cuando se requiere de una identificación exacta. Para el uso común es más práctica la nomenclatura primeramente descrita. | ||
| + | |||
Características de las enzimas. Desde el punto de vista estructural hay dos tipos de enzimas: las que son proteínas puras y las que están compuestas por una parte proteica llamada apoenzima y que constituye la enzima propiamente dicha; pero que para su activación requiere de un cofactor. El cofactor puede ser de cualquiera de los tres tipos siguientes: | Características de las enzimas. Desde el punto de vista estructural hay dos tipos de enzimas: las que son proteínas puras y las que están compuestas por una parte proteica llamada apoenzima y que constituye la enzima propiamente dicha; pero que para su activación requiere de un cofactor. El cofactor puede ser de cualquiera de los tres tipos siguientes: | ||
| + | |||
a) Grupo prostético El grupo prostético es un cofactor no proteico que se encuentra unido por enlace covalente a la parte proteica, convirtiéndola así en una heteroproteína o proteína conjugada. | a) Grupo prostético El grupo prostético es un cofactor no proteico que se encuentra unido por enlace covalente a la parte proteica, convirtiéndola así en una heteroproteína o proteína conjugada. | ||
| + | |||
b) Coenzima. Esta es una molécula de naturaleza orgánica, pequeña, termoestable, y que se puede separar fácilmente de la parte proteica, pero que, no obstante, participa de la actividad enzimática. La parte proteica recibe el nombre de apoenzima, y su complementación con la coenzima recibe el nombre de holoenzima. | b) Coenzima. Esta es una molécula de naturaleza orgánica, pequeña, termoestable, y que se puede separar fácilmente de la parte proteica, pero que, no obstante, participa de la actividad enzimática. La parte proteica recibe el nombre de apoenzima, y su complementación con la coenzima recibe el nombre de holoenzima. | ||
| + | |||
c) Activador metálico. Estos son cationes metálicos mono o bivalentes, tales como K+, Mn2+, Mg2+, Ca2+, Zn2+ que pueden estar débil o fuertemente adheridos a la enzima. Cuando se separa a la apoenzima de su cofactor, ésta permanece inactiva. La mayoría de las enzimas son de este último tipo y recibe el nombre de holoenzima cuando la apoenzima está unida a su cofactor (figura 1). | c) Activador metálico. Estos son cationes metálicos mono o bivalentes, tales como K+, Mn2+, Mg2+, Ca2+, Zn2+ que pueden estar débil o fuertemente adheridos a la enzima. Cuando se separa a la apoenzima de su cofactor, ésta permanece inactiva. La mayoría de las enzimas son de este último tipo y recibe el nombre de holoenzima cuando la apoenzima está unida a su cofactor (figura 1). | ||
| − | Figura 1. La parte proteica, llamada apoenzima y el cofactor unidos forman la holoenzima | + | <center>[[Archivo:Holoenzima AVB.jpg|600px]]</center> |
| + | |||
| + | <center>Figura 1. La parte proteica, llamada apoenzima y el cofactor unidos forman la holoenzima</center> | ||
| + | |||
| + | |||
Entre las características de las enzimas, existen cuatro que todas comparten: | Entre las características de las enzimas, existen cuatro que todas comparten: | ||
| + | |||
1) Únicamente catalizan reacciones termodinámicamente posibles, pero lo hacen a gran velocidad. | 1) Únicamente catalizan reacciones termodinámicamente posibles, pero lo hacen a gran velocidad. | ||
| + | |||
2) Las enzimas no se ven alteradas permanentemente a consecuencia de las reacciones que catalizan, por lo cual la misma enzima puede catalizar innumerables veces la reacción. | 2) Las enzimas no se ven alteradas permanentemente a consecuencia de las reacciones que catalizan, por lo cual la misma enzima puede catalizar innumerables veces la reacción. | ||
| + | |||
3) La misma enzima puede trabajar en la reacción inversa. | 3) La misma enzima puede trabajar en la reacción inversa. | ||
| + | |||
4) Las enzimas son altamente específicas y actúan únicamente sobre un sustrato. | 4) Las enzimas son altamente específicas y actúan únicamente sobre un sustrato. | ||
| + | |||
| + | |||
Interacción Enzima-sustrato. | Interacción Enzima-sustrato. | ||
| + | |||
Como ya se mencionó, la dinámica celular depende de que se realicen un sinnúmero de reacciones bioquímicas, las cuáles son catalizadas por las enzimas; así, se dice que el sustrato es la sustancia sobre la que actúa, y se trata de moléculas que la enzima puede reconocer químicamente, unirse a ellas y actuar para catalizar una reacción específica. Ya que las enzimas son específicas para un sustrato, se debe tener un mecanismo de reconocimiento del sustrato a catalizar. Dicho mecanismo consiste en una porción de la molécula enzimática llamado “sitio activo” (figura 1). Este sitio suele consistir en un grupo de aminoácidos específicos. | Como ya se mencionó, la dinámica celular depende de que se realicen un sinnúmero de reacciones bioquímicas, las cuáles son catalizadas por las enzimas; así, se dice que el sustrato es la sustancia sobre la que actúa, y se trata de moléculas que la enzima puede reconocer químicamente, unirse a ellas y actuar para catalizar una reacción específica. Ya que las enzimas son específicas para un sustrato, se debe tener un mecanismo de reconocimiento del sustrato a catalizar. Dicho mecanismo consiste en una porción de la molécula enzimática llamado “sitio activo” (figura 1). Este sitio suele consistir en un grupo de aminoácidos específicos. | ||
| + | |||
La manera como se constituye el complejo enzima – sustrato ha sido explicado por Emil Fischer (1980) a través de un modelo denominado llave – cerradura, el cual propone que el sustrato encaja en la enzima como una llave en cerradura; es decir, debe haber una complementación tridimensional entre ambos (ver figura 2.). | La manera como se constituye el complejo enzima – sustrato ha sido explicado por Emil Fischer (1980) a través de un modelo denominado llave – cerradura, el cual propone que el sustrato encaja en la enzima como una llave en cerradura; es decir, debe haber una complementación tridimensional entre ambos (ver figura 2.). | ||
| + | |||
| + | <center>[[Archivo:FischerAVB.jpg]]</center> | ||
| − | Figura 2. La propuesta hipotética de Emil Fischer explica la interacción enzima – sustrato mediante una secuencia específica de aminoácidos en la proteína enzimática donde encaja el sustrato como una llave en su cerradura. Esta interacción ocurre en milisegundos, después de lo cual, el o los productos se separan de la enzima. | + | <center>Figura 2. La propuesta hipotética de Emil Fischer explica la interacción enzima – sustrato mediante una secuencia específica de aminoácidos en la proteína enzimática donde encaja el sustrato como una llave en su cerradura. Esta interacción ocurre en milisegundos, después de lo cual, el o los productos se separan de la enzima.</center> |
| − | Factores que afectan la actividad enzimática. Las condiciones físico químicas en las que se desenvuelva una enzima dependerán del órgano y tipo celular donde se encuentre, así como la función que realice; así, tenemos que en cuanto a condiciones medioambientales, la temperatura y el pH desempeñarán un papel primordial en la velocidad de reacción; mientras que otros factores que también afectan la dinámica de la reacción, son la concentración tanto de la enzima como del sustrato, así como la presencia de sustancias inhibidoras, tanto competitivas como no competitivas. | + | |
| + | |||
| + | Factores que afectan la actividad enzimática. | ||
| + | |||
| + | Las condiciones físico químicas en las que se desenvuelva una enzima dependerán del órgano y tipo celular donde se encuentre, así como la función que realice; así, tenemos que en cuanto a condiciones medioambientales, la temperatura y el pH desempeñarán un papel primordial en la velocidad de reacción; mientras que otros factores que también afectan la dinámica de la reacción, son la concentración tanto de la enzima como del sustrato, así como la presencia de sustancias inhibidoras, tanto competitivas como no competitivas. | ||
| + | |||
Concentración de la enzima. Normalmente la velocidad de la reacción catalizada es directamente proporcional a la concentración de la enzima. A mayor cantidad de enzima presente en un mismo tiempo, se obtiene una mayor cantidad de producto cuando se tiene una cantidad ilimitada de sustrato (figura 3). | Concentración de la enzima. Normalmente la velocidad de la reacción catalizada es directamente proporcional a la concentración de la enzima. A mayor cantidad de enzima presente en un mismo tiempo, se obtiene una mayor cantidad de producto cuando se tiene una cantidad ilimitada de sustrato (figura 3). | ||
| − | + | <center>[[Archivo:Conc. enzima AVB.jpg|300px]]</center> | |
| − | Figura 3. La cantidad de producto se incrementa cuando se duplica, triplica o cuadriplica la concentración de la enzima. Esto ocurre si la cantidad de sustrato es ilimitado. | + | |
| + | <center>Figura 3. La cantidad de producto se incrementa cuando se duplica, triplica o cuadriplica la concentración de la enzima. Esto ocurre si la cantidad de sustrato es ilimitado.</center> | ||
| + | |||
| + | |||
Concentración del sustrato. Ante una cantidad fija de enzima, si variamos la cantidad de sustrato, la cantidad de producto (s) se incrementa hasta cierto límite, donde se mantiene sin importar una mayor adición de sustrato (ver figura 4) | Concentración del sustrato. Ante una cantidad fija de enzima, si variamos la cantidad de sustrato, la cantidad de producto (s) se incrementa hasta cierto límite, donde se mantiene sin importar una mayor adición de sustrato (ver figura 4) | ||
| − | + | <center>[[Archivo:Conc. sustrato AVB.jpg|400px]]</center> | |
| − | Figura 4. Relación entre la concentración de enzima y la cantidad de sustrato transformado por unidad de tiempo. La cinética de orden cero se refiere a un punto en el que la enzima no puede incrementar su velocidad de reacción. | + | |
| + | |||
| + | <center>Figura 4. Relación entre la concentración de enzima y la cantidad de sustrato transformado por unidad de tiempo. La cinética de orden cero se refiere a un punto en el que la enzima no puede incrementar su velocidad de reacción.</center> | ||
| + | |||
Efecto de la temperatura. Desde la época de Louis Pasteur es bien sabido que el calor inhibe la actividad vital. En efecto, en la época actual sabemos que el calor puede cambiar la estructura de las proteínas enzimáticas al modificar su estructura, y por lo tanto el sitio activo, lo cuál cancela su posibilidad catalizadora, la cual, llegado cierto punto es irreversible. También sabemos que las enzimas tienen un rango de temperatura en la que pueden funcionar adecuadamente; y en efecto, las temperaturas cercanas al punto de congelación (0°C), la velocidad de reacción es baja y se incrementa conforme la temperatura sube; esto hasta cierto grado, pues si se rebasa por mucho la temperatura de 36°C típica de los homeotermos (organismos que mantienen constante su temperatura corporal, como aves y mamíferos), las proteínas empiezan a dañarse y la velocidad de reacción decae. Un humano puede morir cuando su temperatura interna alcanza los 440 C (ver figura 5). | Efecto de la temperatura. Desde la época de Louis Pasteur es bien sabido que el calor inhibe la actividad vital. En efecto, en la época actual sabemos que el calor puede cambiar la estructura de las proteínas enzimáticas al modificar su estructura, y por lo tanto el sitio activo, lo cuál cancela su posibilidad catalizadora, la cual, llegado cierto punto es irreversible. También sabemos que las enzimas tienen un rango de temperatura en la que pueden funcionar adecuadamente; y en efecto, las temperaturas cercanas al punto de congelación (0°C), la velocidad de reacción es baja y se incrementa conforme la temperatura sube; esto hasta cierto grado, pues si se rebasa por mucho la temperatura de 36°C típica de los homeotermos (organismos que mantienen constante su temperatura corporal, como aves y mamíferos), las proteínas empiezan a dañarse y la velocidad de reacción decae. Un humano puede morir cuando su temperatura interna alcanza los 440 C (ver figura 5). | ||
| − | Figura 5. Relación entre la temperatura y la velocidad de reacción enzimática. | + | <center>[[Archivo:Temp. AVB.jpg|400px]]</center> |
| + | |||
| + | <center>Figura 5. Relación entre la temperatura y la velocidad de reacción enzimática.</center> | ||
| + | |||
| + | |||
Una vez que una enzima ha sido dañada por altas temperaturas ya no se puede volver nuevamente funcional. Esta es la razón por la que es más seguro comer alimentos cocinados que crudos, ya que, al cocinarse, las altas temperaturas inactivan las enzimas de los microorganismos presentes y éstos mueren. A diferencia de las altas temperaturas, las temperaturas bajas no producen daño permanente a las enzimas, usualmente al bajar la temperatura la actividad enzimática disminuye y hasta puede detenerse, pero al aumentar la temperatura la enzima puede volver a activarse. | Una vez que una enzima ha sido dañada por altas temperaturas ya no se puede volver nuevamente funcional. Esta es la razón por la que es más seguro comer alimentos cocinados que crudos, ya que, al cocinarse, las altas temperaturas inactivan las enzimas de los microorganismos presentes y éstos mueren. A diferencia de las altas temperaturas, las temperaturas bajas no producen daño permanente a las enzimas, usualmente al bajar la temperatura la actividad enzimática disminuye y hasta puede detenerse, pero al aumentar la temperatura la enzima puede volver a activarse. | ||
Efecto del pH. La acidez o alcalinidad del medio en el que se encuentre una enzima puede afectar sus propiedades catalíticas. Sabemos que el pH neutro es de 7, y que cualquier valor por debajo de 7 corresponde a un medio ácido. Así, los valores ácidos van del 0 al 7; entre más ácida es una solución su pH será más bajo. Por arriba de 7 y hasta un valor de 14 tenemos los pH alcalinos; entre más alto el valor del pH por arriba de 7, más alcalina es la solución. | Efecto del pH. La acidez o alcalinidad del medio en el que se encuentre una enzima puede afectar sus propiedades catalíticas. Sabemos que el pH neutro es de 7, y que cualquier valor por debajo de 7 corresponde a un medio ácido. Así, los valores ácidos van del 0 al 7; entre más ácida es una solución su pH será más bajo. Por arriba de 7 y hasta un valor de 14 tenemos los pH alcalinos; entre más alto el valor del pH por arriba de 7, más alcalina es la solución. | ||
| + | |||
Debido a que las enzimas son proteínas, éstas se pueden ver afectadas en sus grupos amino y carboxilo que son de carácter iónico, y, en consecuencia, modificar sus propiedades catalíticas. Un alto nivel de acidez o alcalinidad pueden producir desnaturalización de las proteínas; así, la velocidad de reacción de las enzimas decae tanto a pH ácido, como alcalino, y aunque existen importantes excepciones, en general el pH óptimo para la actividad enzimática es cercano a 7 (figura 6). | Debido a que las enzimas son proteínas, éstas se pueden ver afectadas en sus grupos amino y carboxilo que son de carácter iónico, y, en consecuencia, modificar sus propiedades catalíticas. Un alto nivel de acidez o alcalinidad pueden producir desnaturalización de las proteínas; así, la velocidad de reacción de las enzimas decae tanto a pH ácido, como alcalino, y aunque existen importantes excepciones, en general el pH óptimo para la actividad enzimática es cercano a 7 (figura 6). | ||
| − | Figura 6. Relación entre el pH y la velocidad de reacción enzimática. | + | <center>[[Archivo:Enzima pH AVB.jpg|400px]]</center> |
| + | |||
| + | <center>Figura 6. Relación entre el pH y la velocidad de reacción enzimática.</center> | ||
| + | |||
| + | |||
En las células existen sustancias amortiguadoras del pH que evitan que el citoplasma se acidifique o alcalinice y lo mantienen en un pH adecuado o muy cercano a él. Al igual que las bajas temperaturas el pH ácido puede ser usado para conservar alimentos (por ejemplo; en vinagre, que es ácido acético), ya que las enzimas de los microbios que descomponen los alimentos no pueden tolerar las condiciones ácidas. | En las células existen sustancias amortiguadoras del pH que evitan que el citoplasma se acidifique o alcalinice y lo mantienen en un pH adecuado o muy cercano a él. Al igual que las bajas temperaturas el pH ácido puede ser usado para conservar alimentos (por ejemplo; en vinagre, que es ácido acético), ya que las enzimas de los microbios que descomponen los alimentos no pueden tolerar las condiciones ácidas. | ||
| − | Inhibición enzimática. La inhibición enzimática se produce cuando una molécula que no es el sustrato normal con el que funciona la enzima es capaz, debido a similitud molecular, de combinarse con la enzima, boqueando su actividad catalítica. Se han identificado dos clases de inhibición: a) Por competencia y b) No competitiva. | + | |
| + | |||
| + | Inhibición enzimática. | ||
| + | |||
| + | La inhibición enzimática se produce cuando una molécula que no es el sustrato normal con el que funciona la enzima es capaz, debido a similitud molecular, de combinarse con la enzima, boqueando su actividad catalítica. Se han identificado dos clases de inhibición: a) Por competencia y b) No competitiva. | ||
Inhibición competitiva. Se da cuando un compuesto compite, ya sea con el sustrato o con la coenzima para ocupar el sitio activo de la enzima. Se le llama competitiva porque al ocupar la molécula inhibidora el sitio activo, ésta puede ser desplazada al aumentar la cantidad de sustrato. Las moléculas más abundantes (sustrato o inhibidora) serán las que ocupen el sitio activo. Por ejemplo; la deshidrogenasa succínica oxida rápidamente el ácido succínico transformándolo en fumárico. Si se agregan concentraciones crecientes de ácido malónico, cuya estructura molecular es muy parecida a la del ácido succínico, la deshidrogenasa reduce considerablemente su actividad. Esta inhibición es reversible, ya que basta con aumentar la concentración de ácido succínico para que reaparezca la actividad enzimática. | Inhibición competitiva. Se da cuando un compuesto compite, ya sea con el sustrato o con la coenzima para ocupar el sitio activo de la enzima. Se le llama competitiva porque al ocupar la molécula inhibidora el sitio activo, ésta puede ser desplazada al aumentar la cantidad de sustrato. Las moléculas más abundantes (sustrato o inhibidora) serán las que ocupen el sitio activo. Por ejemplo; la deshidrogenasa succínica oxida rápidamente el ácido succínico transformándolo en fumárico. Si se agregan concentraciones crecientes de ácido malónico, cuya estructura molecular es muy parecida a la del ácido succínico, la deshidrogenasa reduce considerablemente su actividad. Esta inhibición es reversible, ya que basta con aumentar la concentración de ácido succínico para que reaparezca la actividad enzimática. | ||
| + | |||
Inhibición no competitiva. Se da cuando el inhibidor, una vez que ocupa el sitio activo de la enzima, no puede ser desplazado al aumentar la concentración de sustrato, ya que el inhibidor se adhiere fuertemente a un punto de la superficie enzimática de donde ya no se separa. Los inhibidores competitivos se unen a un sitio distinto al sitio activo de la enzima, a menudo deformando la enzima, de manera que ésta no forma parte del complejo enzima-sustrato; además, una vez formado el complejo enzima-sustrato no se descompone a la velocidad necesaria para suministrar los productos. | Inhibición no competitiva. Se da cuando el inhibidor, una vez que ocupa el sitio activo de la enzima, no puede ser desplazado al aumentar la concentración de sustrato, ya que el inhibidor se adhiere fuertemente a un punto de la superficie enzimática de donde ya no se separa. Los inhibidores competitivos se unen a un sitio distinto al sitio activo de la enzima, a menudo deformando la enzima, de manera que ésta no forma parte del complejo enzima-sustrato; además, una vez formado el complejo enzima-sustrato no se descompone a la velocidad necesaria para suministrar los productos. | ||
| − | Los inhibidores competitivos tienen múltiples usos; por ejemplo, en medicina se emplean para inhibir algunas enzimas bacterianas. Las sulfas se le han suministrado a personas con el fin de atacar a las bacterias capaces de producir enfermedades: desde infecciones en las vías urinarias hasta neumonía. Las sulfas bloquean en las bacterias la transformación del ácido para-aminobenzoico en la esencial coenzima ácido fólico, que es una vitamina (figura 7). La sulfa ocupa el sitio activo de la enzima e inhibe la producción del ácido fólico, que es esencial para la bacteria. | + | |
| − | + | Los inhibidores competitivos tienen múltiples usos; por ejemplo, en medicina se emplean para inhibir algunas enzimas bacterianas. Las sulfas se le han suministrado a personas con el fin de atacar a las bacterias capaces de producir enfermedades: desde infecciones en las vías urinarias hasta neumonía. Las sulfas bloquean en las bacterias la transformación del ácido para-aminobenzoico en la esencial coenzima ácido fólico, que es una vitamina (figura 7). La sulfa ocupa el sitio activo de la enzima e inhibe la producción del ácido fólico, que es esencial para la bacteria. | |
| − | + | ||
| − | Figura 7. Comparación de la estructura química del ácido para-aminobenzoico y la sulfa. | + | <center>[[Archivo:Para amino sulfa AVB.jpg]]</center> |
| + | |||
| + | <center>Figura 7. Comparación de la estructura química del ácido para-aminobenzoico y la sulfa.</center> | ||
| + | |||
Como las bacterias ahora son incapaces de producir el ácido fólico dejan de proliferar, ya que sus reacciones enzimáticas dependen de esta coenzima. A nosotros no nos afectan las sulfas, aunque requerimos del ácido fólico, pero nuestro organismo no lo fabrica pues lo obtenemos de la dieta. | Como las bacterias ahora son incapaces de producir el ácido fólico dejan de proliferar, ya que sus reacciones enzimáticas dependen de esta coenzima. A nosotros no nos afectan las sulfas, aunque requerimos del ácido fólico, pero nuestro organismo no lo fabrica pues lo obtenemos de la dieta. | ||
| + | |||
Existen otros tipos de inhibición como la alostérica, en la que sustancias diversas afectan la estructura cuaternaria de la enzima, o el caso de algunos metales pesados (por ejemplo, plomo, arsénico o mercurio), que también alteran la forma, y por lo tanto la actividad catalítica. | Existen otros tipos de inhibición como la alostérica, en la que sustancias diversas afectan la estructura cuaternaria de la enzima, o el caso de algunos metales pesados (por ejemplo, plomo, arsénico o mercurio), que también alteran la forma, y por lo tanto la actividad catalítica. | ||
| + | |||
| + | |||
Rutas Metabólicas | Rutas Metabólicas | ||
| + | |||
Como hemos visto, por su estructura primordialmente proteica, las enzimas son los agentes a través de los cuales el DNA controla la mayor parte de la actividad de los sistemas vivos. No obstante, rara vez la formación o degradación de sustancias en dichos sistemas vivientes son de un solo paso con una sola enzima implicada en el proceso. En efecto, la obtención de sustancias complejas, o, por el contrario, la degradación de sustancias complejas a simples, por lo general requieren de una serie de reacciones secuenciales en donde cada reacción es catalizada por una enzima específica. La serie de reacciones que llevan de unos reactivos a ciertos productos finales, se llaman rutas metabólicas. | Como hemos visto, por su estructura primordialmente proteica, las enzimas son los agentes a través de los cuales el DNA controla la mayor parte de la actividad de los sistemas vivos. No obstante, rara vez la formación o degradación de sustancias en dichos sistemas vivientes son de un solo paso con una sola enzima implicada en el proceso. En efecto, la obtención de sustancias complejas, o, por el contrario, la degradación de sustancias complejas a simples, por lo general requieren de una serie de reacciones secuenciales en donde cada reacción es catalizada por una enzima específica. La serie de reacciones que llevan de unos reactivos a ciertos productos finales, se llaman rutas metabólicas. | ||
| + | |||
Es común comparar las rutas metabólicas con la producción industrial en serie, donde en el paso A se hace determinado montaje a partir del cual, en el siguiente paso B, se parte de A; mientras que el paso C requiere de que el paso B se haya cumplido. En este caso, la enzima 1 cataliza cierta reacción generando un producto que a su vez sirve de sustrato para la enzima 2 y así sucesivamente: | Es común comparar las rutas metabólicas con la producción industrial en serie, donde en el paso A se hace determinado montaje a partir del cual, en el siguiente paso B, se parte de A; mientras que el paso C requiere de que el paso B se haya cumplido. En este caso, la enzima 1 cataliza cierta reacción generando un producto que a su vez sirve de sustrato para la enzima 2 y así sucesivamente: | ||
| − | + | <center>[[Archivo:Ruta metabolica AVB.jpg]]</center> | |
| − | + | ||
Teóricamente, cualquiera de estas reacciones es reversible, por lo que para que la ruta metabólica fluya como en el esquema, se requiere de ciertas condiciones de concentración de los sustratos de cada una de las enzimas implicadas en el proceso. Es decir, debe haber una mayor concentración de sustrato que de la sustancia A, que a su vez debe estar más concentrada que la sustancia B y así sucesivamente. | Teóricamente, cualquiera de estas reacciones es reversible, por lo que para que la ruta metabólica fluya como en el esquema, se requiere de ciertas condiciones de concentración de los sustratos de cada una de las enzimas implicadas en el proceso. Es decir, debe haber una mayor concentración de sustrato que de la sustancia A, que a su vez debe estar más concentrada que la sustancia B y así sucesivamente. | ||
| + | |||
Por otra parte, no todas las rutas metabólicas son lineales; con frecuencia ocurre que se encuentran bifurcadas: | Por otra parte, no todas las rutas metabólicas son lineales; con frecuencia ocurre que se encuentran bifurcadas: | ||
| − | + | <center>[[Archivo:Cascada metabolica AVB.jpg]]</center> | |
| − | + | El control de la mayoría de estas reacciones es de tipo alostérico. Es decir, los productos son capaces de bloquear su propia producción uniéndose y bloqueando a la enzima cuando su concentración llega a cierto límite | |
| − | + | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | ORIGEN DE LAS FIGURAS. | ||
| − | + | Figura 1. Modificado de: https://www.eluniversal.com.mx/articulo/deportes/futbol/2015/08/23/que-pumas-no-sea-flor-de-un-solo-dia Consulta: 13/01/2019 | |
| − | Figura 1. | + | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | Figura | + | Figura 2. https://www.quora.com/What-are-the-differences-between-ATP-and-ADP Consulta: 13/01/2019 |
| − | Figura | + | Figura 3. Modificada de: https://www.istockphoto.com/mx/vector/ciclo-de-atp-adp-transferencia-de-energ%C3%ADa-intracelular-gm1071481764-286743304 Consulta: 13/01/2019 |
| − | Figura 1. 2. 10. www.geocities.ws | + | Figura 1. Imagen original de los autores. |
| − | Figura | + | |
| − | Figura | + | Figura 2. www.whatsthatbug.com Consulta: 13/01/2019 |
| − | Figura | + | |
| − | Figura | + | Figura 3 www.lingote.site50.net Consulta: 13/01/2019 |
| − | Figura | + | |
| − | Figura | + | Figura 4. www. medicina4all.wordpress.com Consulta: 13/01/2019 |
| − | Figura | + | |
| − | b) Modificado de: https://es.slideshare.net/calislauri/metabolismo-de-los-nucleotidos-de-purina-y-pirimidina | + | Figura 5. www: genesis.uag.mx Consulta: 13/01/2019 |
| + | |||
| + | Figura 6. www.genomasur.com Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 7. www.kimiexplorer.wikispaces.com Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 8. www.estonoescomida.com Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 9. www.um.es Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 10. www.geocities.ws Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 11. https://www.google.com/search?q=guacamayas+volando&client=firefox-b-d&source=lnms&tbm=isch&sa=X&ved=0ahUKEwiDtrjvj-rhAhUHca0KHYw_CS0Q_AUIDigB&biw=1760&bih=886#imgrc=U7C-QNdpIHEb6M: Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 12. http://www.aula2005.com/html/cn3eso/15endocri/15endocries.htm Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 13. http://www.actualidadganadera.com/biomont/articulos/tracto-digestivo-del-ternero-lactante-y-absorcion-de-vitaminas-liposolubles.html Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 14. Modificado de: https://acidoclorhidrico.org/fosfato-de-calcio/ Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 15. https://diferencias.eu/entre-ribosa-y-desoxirribosa/ Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 16. Modificado de: https://www.acidosnucleicos.net/bases-nitrogenadas/ Consulta: 13/01/2019 | ||
| + | |||
| + | Figura 17. a) Modificado de: https://www.ucm.es/data/cont/media/www/pag-56185/02-Estructura%20de%20los%20%C3%A1cidos%20nucl%C3%A9icos.pdf Consulta: 13/01/2019 | ||
| + | |||
| + | b) Modificado de: https://es.slideshare.net/calislauri/metabolismo-de-los-nucleotidos-de-purina-y-pirimidina Consulta: 13/01/2019 | ||
Cuadro 1. 3. 1. | Cuadro 1. 3. 1. | ||
| − | Figura | + | Figura 1. Modificado de: https://docplayer.es/44054825-Bloque-i-proteinas-y-enzimas.html y https://slideplayer.es/slide/12810991/ Consulta: 13/01/2019 |
| − | Figura | + | |
| − | Figura | + | Figura 2. http://apuntesbiotecnologiageneral.blogspot.com/2014/09/como-se-descubrieron-las-enzimas.html Consulta: 13/01/2019 |
| + | |||
| + | Figura 3. Modificado de: https://slideplayer.es/slide/5506411/ Consulta: 13/01/2019 | ||
Revisión actual del 02:27 22 ago 2019
Aprendizaje.
El alumno:
Compara el anabolismo y catabolismo como procesos de síntesis y degradación para la conservación de los sistemas biológicos.
Relaciona los carbohidratos, lípidos, proteínas y nucleótidos con los procesos metabólicos de transformación de energía.
Comprende el papel de las enzimas en las reacciones metabólicas.
• Metabolismo: Anabolismo y Catabolismo
Como puedes observar en el título de esta unidad, el eje es la conservación de los sistemas biológicos, de modo que lo primero que debemos hacer es dejar en claro a qué nos referimos con conservación. El término proviene del latín conservatio, que es la acción y efecto de conservar (mantener, cuidar o guardar algo, e incluso continuar con la práctica de costumbres). En este caso, nos referiremos al mantenimiento de los sistemas vivos; tanto en su constitución y el mantenimiento de éste a través del tiempo, así como a la degradación de ciertas moléculas para afrontar el gasto energético que implica su manifestación como ser viviente.
Para abordar la temática, podemos partir de imaginar un ser en plenitud, el que gustes, un jaguar, un tapir, una boa constrictor, un oso, un roble, un encino, un protozoo o una persona. Imagínala ya formada, con una variedad de cientos y hasta miles de compuestos químicos distintos; no hay duda de que estaríamos de acuerdo en que la dinámica de estos componentes sería muy compleja, sobre todo si pensamos que debe cumplir con ciertas funciones: bombear sangre por sus venas, conseguir alimento o pareja, recorrer su hábitat, hacer fotosíntesis, regenerar células que pudiesen morir, etc. Justo toda esa serie de funciones y actividades es lo que llamaríamos mantenimiento. Y por lo tanto, lo siguiente que surge, naturalmente, es una pregunta ¿cómo los organismos logramos mantenernos? La respuesta es: a través del metabolismo.
Formalmente, el metabolismo se define como la suma de reacciones bioquímicas que ocurren dentro de un sistema vivo. Pero si pensamos en los Cinco Reinos, de inmediato caemos en la cuenta de que, sin temor a equivocarnos, podemos decir que las diferencias entre los sistemas vivos se deben fundamentalmente a su metabolismo. No obstante, existen grados de diferencia; es decir, las diferencias metabólicas entre seres humanos son mínimas; mientras que las diferencias metabólicas entre los grandes grupos taxonómicos (entre los reinos plantae y animalia, por ejemplo), sí son considerables. Por lo tanto, podemos decir que la diversidad metabólica que se ha desarrollado en el planeta a lo largo de la historia de la vida ha dado como resultado la diversidad de formas vivientes que en la actualidad podemos observar.
Así, podemos afirmar que un ser vivo es un sistema que intercambia materia y energía con el medio externo y que tal intercambio no es aleatorio, pues está controlado por el propio organismo (aunque con gran frecuencia el ambiente presenta, estacionalmente, limitaciones en la oferta de algunos de sus componentes. Por ejemplo: la lluvia, la temperatura, la cantidad de luz, etc.). Ciertamente, el organismo se encarga de administrar sus insumos para realizar todas sus funciones: tanto para fabricar sus componentes estructurales y funcionales, como para darse automantenimiento y realizar el manejo energético que le permita manifestarse como ente vivo, pero al mismo tiempo elimina desechos (ver figura 1).
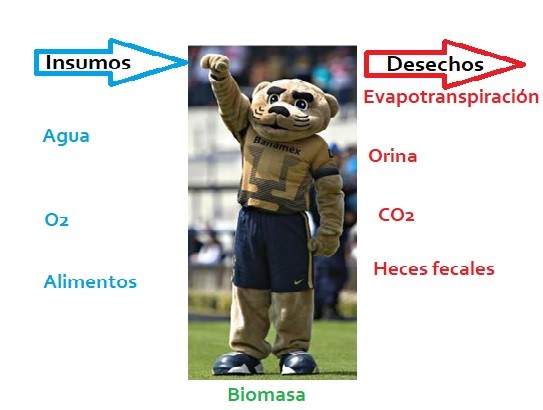
Cualesquiera que sean los usos a que se reserven los recursos obtenidos, es importante señalar que tales insumos no pueden ser manejados en crudo; el organismo debe darles un tratamiento bioquímico para disponer de ellos, y, como ya hemos visto, a toda la serie de reacciones bioquímicas que ocurren en un organismo se les da el nombre de metabolismo.
Al decir que el metabolismo consiste en la serie de reacciones bioquímicas que ocurren en un sistema vivo, debemos tener en cuenta que muy pocas de tales reacciones son espontáneas y que más bien la gran mayoría de ellas son reacciones catalizadas por enzimas; es decir, los agentes proteicos que aceleran o retardan las reacciones son los responsables directos de la actividad metabólica.
Dependiendo del tipo de reacción bioquímica de que se trate, el metabolismo se divide en Anabolismo y Catabolismo. Todas las reacciones de síntesis, que casi invariablemente son endoenergéticas (es decir, que requieren de una fuente de energía para realizarse), se clasifican como anabólicas. Por su parte, las reacciones catabólicas son reacciones que implican el rompimiento de una molécula grande en dos o más moléculas más pequeñas, frecuentemente acompañadas de una liberación de energía (reacciones exoenergéticas).
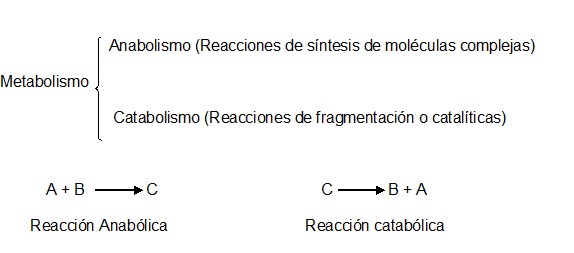
La célula presenta compuestos bioquímicos que absorben o liberan energía y que van aparejados a las reacciones antes señaladas que evitan un derroche energético que pudiese incrementar peligrosamente la temperatura corporal. Estos intermediarios energéticos son generalmente compuestos fosforilados, siendo los más conocidos los fosfatos de adenosina: el difosfato y el trifosfato de adenosina (ADP y ATP).
Así, el ATP es considerado como la “tarjeta” energética de la célula, ya que es transportadora de energía merced a un enlace de fósforo altamente energético y establece un ciclo con el ADP de tarjeta cargada y tarjeta descargada. El ATP se constituye por un nucleótido de adenina, un azúcar ribosa y tres moléculas de ácido fosfórico enlazados (ver figura 2). A partir de la adenosina difosfato (ADP), para que el tercer fosfato se una, se requiere de reacciones endoenergéticas, por lo que el rompimiento del ATP a ADP y fosforo inorgánico Pi, libera tanta energía como 7.7 Kcal/mol.
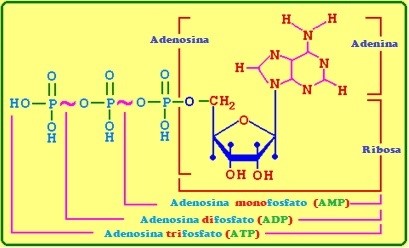
Así, en las células se establece una poza de ADP capaz de energizarse por procesos celulares como la respiración, dando origen a una poza de ATP. El ATP a su vez es capaz de hidrolizarse y liberar un fosfato y la energía correspondiente en sincronía con alguna reacción metabólica que requiera dicha energía. Podríamos decir que la síntesis del ATP es una reacción anabólica y su rompimiento es reacción catabólica (ver figura 3).
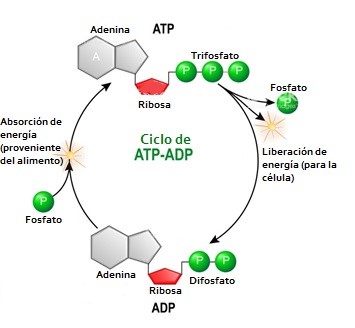
De los fenómenos metabólicos mejor conocidos, podemos mencionar como ejemplo típico de reacción catabólica a la respiración celular, ya que, durante este proceso, la glucosa se rompe en 6 moléculas de CO2 y 6 moléculas de H2O con la consiguiente producción de 36 moléculas ATP (como ganancia neta).
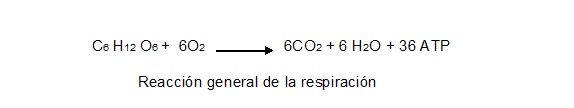
En cuanto a reacción anabólica podemos mencionar como ejemplo típico a la fotosíntesis, ya que gracias al bióxido de carbono (constituido de tres átomos), el agua (también de tres átomos) y mediante la energía luminosa y la clorofila se genera glucosa (C6 H12 O6; es decir, un compuesto de 24 átomos), liberándose como producto de desecho O2. Desde luego, se requieren 6 moléculas de bióxido de carbono y 12 de agua (en realidad, 6 de ellas son realmente incorporadas y 6 son regeneradas al final), por lo que la reacción está balanceada en cuanto al número de átomos de cada elemento, pero es claro que la molécula de glucosa es bastante más grande que cualquiera de los dos reactivos. Otros ejemplos lo son la síntesis de proteínas o de ADN.
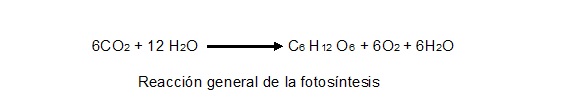
• Carbohidratos, Lípidos, Proteínas y Nucleótidos Como ya hemos mencionado, existen grados de diferencia tanto entre las especies, como entre los individuos. ¿Pero a qué atribuimos tales diferencias? Desde luego que, en primer lugar a los genes, que se expresan a través de proteínas y enzimas (que también tienen naturaleza proteica), y a través del metabolismo desatado por tal actividad enzimática, y finalmente por los compuestos bioquímicos presentes. Pues bien, tales compuestos bioquímicos pertenecen a grupos muy conocidos: Carbohidratos, Lípidos, Proteínas y Nucleótidos. Pero no son los únicos, tenemos también la presencia insoslayable del agua, las sales minerales y las vitaminas. A continuación, desarrollaremos la temática correspondiente a estos compuestos, así como un ejemplo selecto de su participación en el metabolismo de diversas especies.
EL AGUA
El agua se encuentra formando parte de los seres vivos aproximadamente en unas tres cuartas partes de su peso corporal, aunque existen organismos que llegan a estar constituidos por agua hasta en un 99% (en el caso de las medusas) o en el otro extremo, algunos insectos que llegan a tener un 40% (ver figuras 1 – 2).


Funciones biológicas del agua
1. El agua está considerada como el solvente universal. Su molécula polar permite la disolución de prácticamente todos los compuestos polares, tanto inorgánicos como orgánicos.
2. Cumple funciones de transporte. Relacionada con su elevada capacidad disolvente, el agua facilita la formación de torrentes líquidos o semilíquidos que distribuyen sustancias disueltas en los organismos (sangre, savia bruta y elaborada). También permite segregar productos elaborados o eliminar desechos (néctar, orina).
3. Estructura volumétrica. Debido a la gran cohesión que brinda la polaridad de las moléculas de agua y a la solubilidad de algunas sales que le provocan la posibilidad de generar presiones osmóticas, el agua permite dar volumen y turgencia a las células.
4. El agua es un gran termorregulador, ya que, al tener un elevado calor específico, permite mantener constante la temperatura de los seres vivos (que en los humanos es de 36.5° C.
5. Debido a su gran resistencia a ser comprimida, el agua cumple con funciones amortiguadoras; tal es el caso del líquido sinovial, que evita la fricción entre los huesos, o el líquido cefalorraquídeo, que amortigua al sistema nervioso central de los impactos producidos por la locomoción animal.
6. Tiene funciones metabólicas, ya que ofrece un medio fluido y ágil que favorece la realización de reacciones bioquímicas, además participa activamente en diversos procesos como reactivo o como producto (fotosíntesis y respiración, entre otros).
7. Amortigua la temperatura planetaria. En efecto, al cubrir tres cuartas partes de la superficie terrestre, mantiene una temperatura adecuada para la vida, tanto en tierra como en las masas acuáticas, ya que la polaridad molecular del agua genera un mayor volumen al estado sólido, lo que provoca que el hielo flote y mantenga condiciones de vida bajo la costra de hielo polar.
SALES MINERALES
Las sales minerales pueden encontrarse en los organismos de dos maneras principales: i) sólidas en forma de precipitado e ii) disueltas en agua, formando iones (Aniones, el ion negativo como PO43- y Cl-; y Cationes, la parte positiva de la sal como K+, Na+ o Ca+). Cumplen diversas funciones celulares como el mantenimiento de los procesos de presión osmótica y de homeostasis, auxilian en la formación y mantenimiento de los huesos, regulan la actividad enzimática y el volumen celular a través de la presión osmótica, generan potenciales eléctricos importantes para las actividades nerviosa y muscular entre otras funciones (ver figura 3).
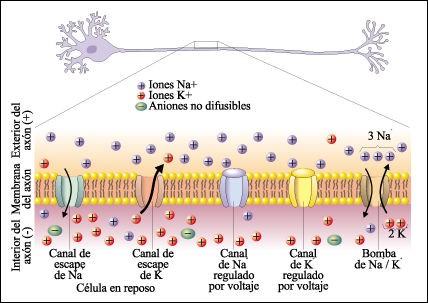
Como participante de los procesos metabólicos, se sabe que algunos minerales actúan como cofactores activadores de las enzimas. A nivel intracelular, existen más de 10 000 enzimas que son necesarias para que el metabolismo funcione correctamente, y estas enzimas no pueden funcionar correctamente si sus activadores minerales no se encuentran presentes.
VITAMINAS
Las vitaminas son sustancias que no tienen una estructura química homogénea, lo que tienen en común es que les son necesarias a los seres vivientes en cantidades muy bajas, del orden de miligramos o microgramos por día. Tienen funciones metabólicas importantes por actuar como, o ser precursores de coenzimas, que son factores imprescindibles para que las enzimas cumplan su función de síntesis o catálisis.
Por su afinidad de solubilidad, las vitaminas pueden ser solubles en agua o en lípidos, como se puede ver en la tabla 1, que además presenta los daños provocados por su carencia:
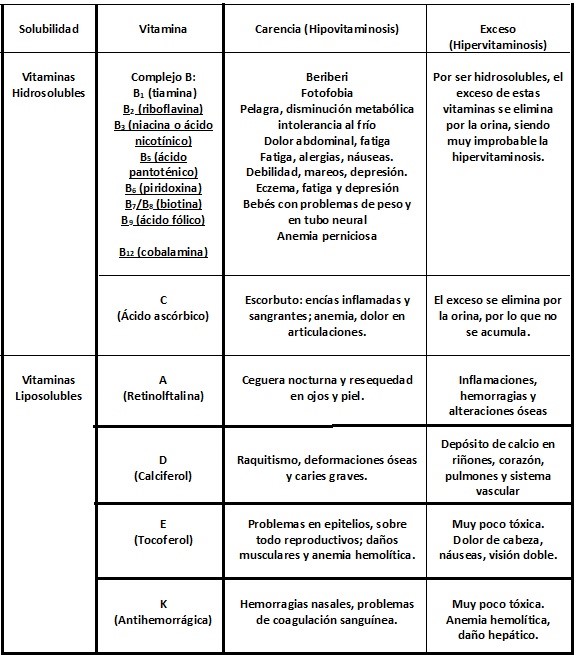
CARBOHIDRATOS
Los carbohidratos, también llamados hidratos de carbono o glúcidos son macromoléculas formadas casi exclusivamente de carbono, hidrógeno y oxígeno, por lo que se les llama compuestos terciarios, (ya que tienen tres de los cuatro elementos biogenéticos: CHON) en donde el hidrógeno y el oxígeno se encuentran generalmente en la misma proporción que el agua por cada carbono presente (CH2O)n, de ahí que se les denominara carbohidratos (de carbo, carbono e hidro, agua) aunque hoy en día se sabe que existen carbohidratos como la desoxirribosa (C5H10O4) en los que el hidrógeno y el oxígeno no guardan esa proporción.
Para su estudio, los carbohidratos se clasifican en cuatro grupos: monosacáridos (una cadena sencilla de entre tres y siete carbonos); disacáridos (dos cadenas unidas); oligosacáridos (entre tres y nueve monosacáridos unidos), y polisacáridos (más de diez cadenas unidas). Cabe aclarar que el término sacárido que en griego significa sabor dulce, se les asigna porque entre estos compuestos se encuentran la glucosa y la sacarosa, que son dulces.
Los monosacáridos son las unidades mínimas que presentan las características de un carbohidrato; químicamente se definen como derivados aldehídicos o cetónicos de alcoholes polivalentes. Los monosacáridos o azúcares simples son moléculas que se componen de cadenas formadas de tres a siete átomos de carbono y su principal característica estructural es la presencia de varios grupos hidroxilo (−OH, también llamados alcoholes). Además, contiene un grupo carbonilo (C=O), que si es terminal genera un aldehído o bien, si es intermedio, origina una cetona, siendo su fórmula general (CH2O)n, donde n representa el número de carbonos presentes en la molécula.
Entre los monosacáridos más conocidos se encuentran la glucosa (ver figura 4) y la fructosa, que son los más abundantes en la naturaleza y cuyo origen está en la fotosíntesis de los vegetales; está también la galactosa, así como la ribosa y la desoxirribosa presentes en los ácidos ribo y desoxirribonucleico (RNA y DNA), respectivamente. La glucosa, de donde se deriva el término glúcido, tiene gran importancia fisiológica en los mamíferos, ya que se requiere determinada concentración de este monosacárido en la sangre (72-145 miligramos por decilitro), de otro modo se presentan diversos problemas. Una concentración más baja (hipoglucemia), puede provocar visión doble, irritabilidad, confusión, e incluso desmayos y convulsiones; esta situación puede presentarse en personas privadas de alimentos, con dietas rigurosas o en personas con problemas de diabetes. Por lo contrario, una concentración elevada (hiperglucemia o diabetes), puede generar sed, visión borrosa, piel seca y necesidad de orinar con frecuencia. De hecho, el organismo fabrica una hormona, la insulina, para controlar los niveles de glucosa en la sangre.
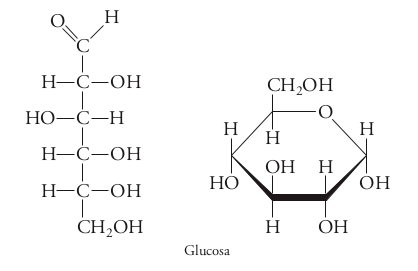
Los disacáridos son carbohidratos formados por la unión de dos monosacáridos, los enlaces que unen a los dos monosacáridos se llaman enlaces glucosídicos, que se forman por el desprendimiento de una molécula de agua de los dos grupos hidroxilo (−OH) contiguos, quedando como enlace un puente de oxígeno que une a dos carbonos de los monosacáridos vecinos.
Entre los disacáridos más conocidos se encuentra la sacarosa o azúcar de mesa (ver figura 5), que se extrae de la caña de azúcar y de la remolacha; otro disacárido común es la lactosa que se encuentra presente en la leche, además de la maltosa que es empleada para la elaboración de cerveza.
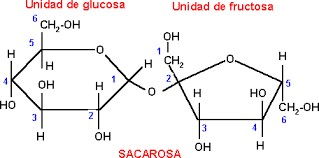
Los oligosacáridos se forman por la unión de entre tres y nueve monosacáridos, con la liberación de una molécula de agua por cada enlace. Un trisacárido muy conocido es un componente común de cacahuates y algunas leguminosas (frijol, soya, garbanzos y chícharos), la rafinosa, que se conforma por la unión de glucosa, fructosa y galactosa. Otros oligosacáridos de mayor peso molecular constituyen glucolípidos o glucoproteínas al asociarse a lípidos o a proteínas. Son importantes constituyentes del glucocálix celular y tienen funciones de señalización y reconocimiento celular.
Los polisacáridos son largas cadenas formadas por la unión de muchos monosacáridos mediante enlaces glucosídicos y que además pueden formar ramificaciones de las cadenas, dando origen a moléculas extremadamente grandes y de un elevado peso molecular. Ejemplos de estos compuestos son: el almidón (ver figura 6), la celulosa y la quitina.
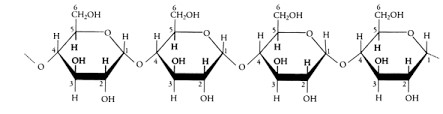
Los polisacáridos tienen dos funciones dentro de la fisiología de las células, una como fuente de energía que las células utilizan y almacenan con bastante eficiencia como el almidón en las plantas y el glucógeno en los animales; de estos carbohidratos los organismos obtienen la energía para sus procesos vitales. La otra función de los polisacáridos es como elementos extracelulares estructurales, como la celulosa y la quitina, la primera refuerza las paredes de las células vegetales y la quitina da rigidez al exoesqueleto de muchos animales, como los caparazones de los artrópodos.
LÍPIDOS
A los lípidos también se les conoce comúnmente con el nombre de grasas y aceites. Los lípidos no son solubles en agua, sino en los llamados solventes orgánicos como el alcohol y la acetona. Constan principalmente de átomos de carbono, hidrógeno y oxígeno (aunque a diferencia de los carbohidratos, tienen mayor cantidad de átomos de hidrógeno y menor cantidad de oxígeno), por lo que hay mayor cantidad de enlaces C−H que son muy ricos en energía. Por eso las grasas proporcionan más del doble de calorías por gramo que los carbohidratos.

Químicamente, los lípidos o grasas son un grupo heterogéneo que tienen en común la presencia de dos componentes fundamentales: glicerol y ácidos grasos. El glicerol (ver figura 7), está formado por tres carbonos hidroxilados a la manera de los azúcares, mientras que los ácidos grasos (ver figura 8), son cadenas de hasta 18 átomos de carbono a los que se encuentran unidos los átomos de hidrógeno y en el extremo de la cadena un grupo carboxilo (−COOH). Una molécula de glicerol se combina con tres moléculas de ácidos grasos para formar una grasa (de ahí el término más técnico de triglicéridos o grasas neutras) (ver figura 9). De ácidos grasos se tienen identificados alrededor de 40.
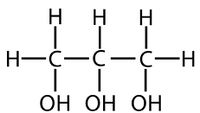 ]
]
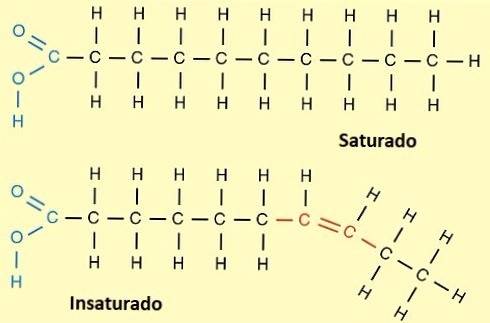
Los ácidos grasos se clasifican comúnmente como saturados e insaturados, dependiendo de la presencia de enlaces sencillos, dobles o triples entre carbonos vecinos (ver figura 8). Los que solo presentan enlaces sencillos entre carbonos vecinos se denominan saturados (normalmente las grasas animales) y los ácidos grasos que presentan enlaces dobles y/o triples entre carbonos vecinos (normalmente las grasa vegetales), se denominan insaturados o poliinsaturados. Generalmente las grasas animales con ácidos grasos de cadenas largas son sólidas (como la manteca) mientras que las grasas vegetales (aceites de semillas) son líquidas a temperatura ambiente.
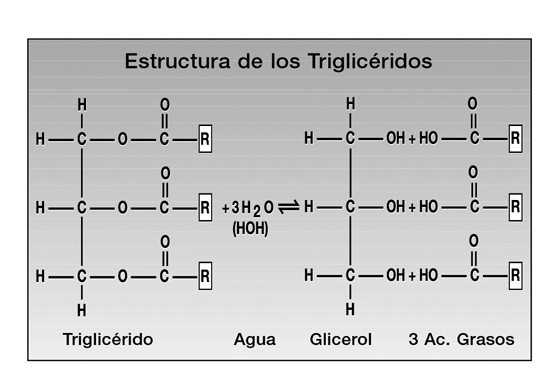
Hay lípidos que no contienen ácidos grasos como componentes, como son los terpenos y los esteroides, ambos de gran importancia para los organismos animales, incluido el hombre. Los terpenos incluyen ciertas vitaminas liposolubles como las vitaminas A, E y K (ver figura 10), así como algunos carotenoides, que son pigmentos de color amarillo a naranja que participan en la fotosíntesis de las células vegetales. Los terpenos son componentes que determinan los aromas y sabores de las plantas, como el mentol, el eucaliptol, el olor de los limones y de los geranios.
Por su parte, los esteroides son un grupo especialmente importante de lípidos, ya que tiene propiedades fisiológicas determinantes para los humanos, a este grupo pertenecen la hormona masculina (testosterona), y las hormonas femeninas (estrógeno y progesterona), también la vitamina D y el colesterol, este último a pesar de su mala fama por estar ligado a la acumulación de lípidos en las arterias, lo que constituye la arterioesclerosis, es importante por formar parte de todas las membranas celulares y por ser precursor de la formación de varias hormonas.
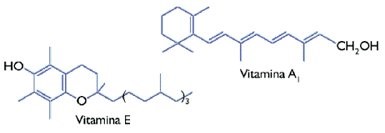
Además de las ya mencionadas, los lípidos en el organismo tienen dos importantes funciones, son parte de la estructura de todas las células formando parte de las membranas celulares (fosfolípidos) y constituyen una fuente de energía y material de reserva que se acumula bajo la piel de los animales y en semillas y frutos de algunos vegetales.
PROTEINAS
Dentro de las macromoléculas, las proteínas son moléculas excepcionalmente grandes, diversas y complejas, y son los compuestos orgánicos más abundantes en los animales, al igual que en las plantas las moléculas más abundantes son los carbohidratos.
Químicamente las proteínas están constituidas por átomos de carbono, hidrógeno, oxígeno y nitrógeno (CHON) por lo que reciben el nombre de elementos cuaternarios, aunque las hay que pueden también contener azufre o fósforo. Estos elementos se organizan en unidades denominadas aminoácidos, de los cuales existen 20 diferentes, los cuales varían en cuanto a su tamaño molecular, pero todos contienen uno o más grupos amino (−NH2) y uno o más grupos carboxilo (−COOH), unidos en una cadena de átomos de carbono mediante enlaces llamados peptídicos que se forman al perderse una molécula de agua entre dos aminoácidos contiguos (ver tabla 2).
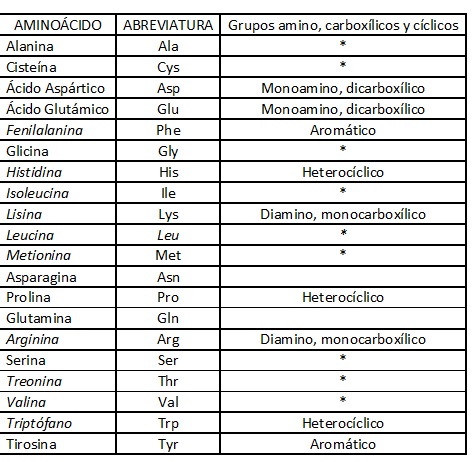
Las proteínas existentes en la naturaleza son largas cadenas de aminoácidos enlazados que contienen entre 50 y 150 000 aminoácidos, y cada uno de estos aminoácidos ocupa en la cadena un lugar exacto, de acuerdo con la fórmula que cada proteína tiene, un solo cambio en la posición de un aminoácido puede inactivar a la proteína. La secuencia de los aminoácidos en la proteína es la que determina la función de ésta: si es una proteína estructural, una enzima o una hormona.
La principal función de las proteínas en el cuerpo de los animales es de tipo estructural, ya que forman los músculos, el pelo, la piel, las uñas, los cartílagos y los huesos, constituyendo más de la mitad del peso seco de las células (ver figura 11). También son fuente de energía pues contienen una cantidad importante de átomos de hidrógeno.

Un grupo muy especial de proteínas son las hormonas (ver figura 12); Otro grupo de proteínas da origen a las enzimas, que funcionan como biocatalizadores de las reacciones químicas que se producen en las células. La variedad de enzimas es impresionante ya que cada una de ellas es específica para una determinada reacción y en nuestro organismo se efectúan más de 100,000 reacciones químicas diferentes (ver figura 13). y un tercer grupo constituye los anticuerpos para la defensa del organismo frente a infecciones de virus y bacterias.
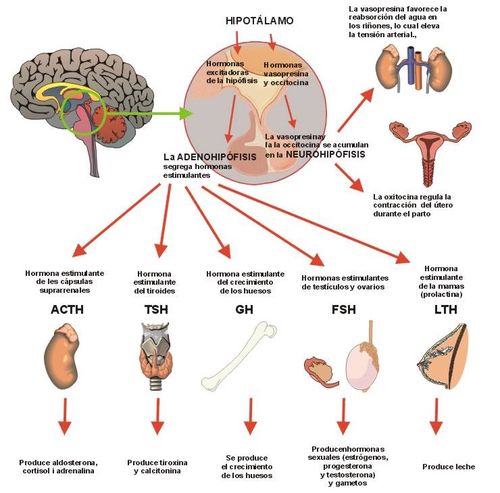

Aunque la dieta animal incluye normalmente proteínas, estas son rotas en sus aminoácidos constituyentes durante el proceso digestivo. Dichos aminoácidos son asimilados en el intestino y llevados a cada célula, donde bajo las órdenes del DNA son reorganizados en nuevas proteínas específicas de cada especie e individuo.
NUCLEOTIDOS
Los nucleótidos son compuestos que contienen CHONP, por lo que exceden lo cuaternario, y se constituyen de tres grupos de compuestos: un azúcar pentosa (con 5 carbonos), una base nitrogenada y un grupo fosfato. Existen dos tipos de nucleótidos, uno, en los que el azúcar es la ribosa y forman el ácido ribonucleico (RNA) y otros en los que el azúcar es la desoxirribosa y forman el ácido desoxirribonucleico (DNA).
La otra estructura diferencial de los nucleótidos son las bases nitrogenadas, que pueden ser de dos tipos: púricas como la adenina y la guanina, y pirimídicas como la timina, la citosina y el uracilo. El DNA contiene la adenina (A), la guanina (G), la citosina (C) y la timina (T); el RNA tiene la adenina, guanina y citosina, pero la timina cambia por el uracilo (U).
Los grupos fosfato y las unidades de azúcar de los nucleótidos se alternan entre sí para formar dos largas cadenas que se enrollan entre sí formando la doble columna de la molécula de DNA que se conoce como doble hélice. Las dos cadenas de nucleótidos de la hélice se unen entre sí a través del eje mediante el apareamiento de las bases nitrogenadas (ver tabla 3).

Químicamente, el fosfato podemos considerarlo derivado del ácido fosfórico, H3PO4. Su estructura se puede ver en la figura 14.
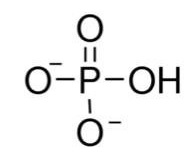
Por su parte los azúcares de 5 carbonos, ribosa y desoxirribosa pueden formar estructuras cíclicas en forma de pentágono, tal como se presenta en la figura 15.
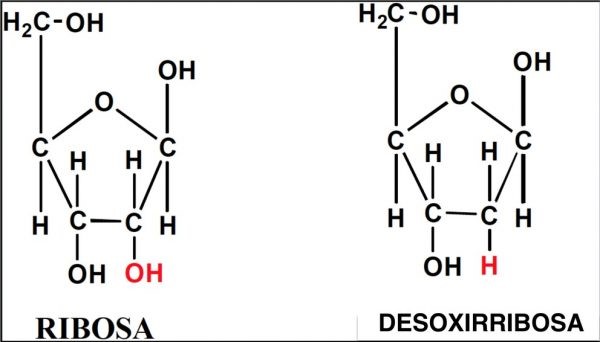
Por su parte, las bases nitrogenadas constituyen los componentes más complejos, ya que las purinas presentan doble estructura cíclica, mientras que las pirimidinas presentan solo una. Las diferencias entre las cinco bases nitrogenadas se pueden constatar en la figura 16; mientras que el ensamblaje de los nucleótidos puede observarse en la figura 17.
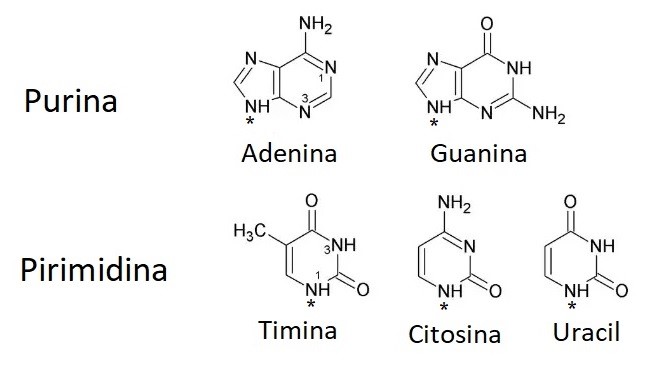
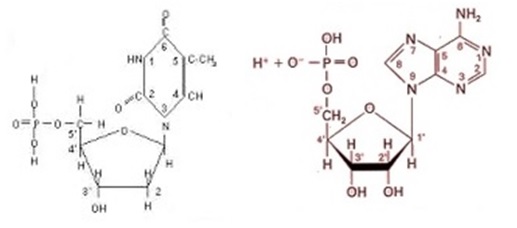
Los nucleótidos tienen gran importancia metabólica, no únicamente como componentes estructurales de los ácidos nucleicos, sino por que son capaces de formar compuestos trifosforilados (como el trifosfato de adenosina o ATP), capaces de almacenar cantidades considerables de energía en sus enlaces, sobre todo entre el segundo y el tercer fosfato. Esto los privilegia como transportadores de energía en el interior celular. Originándose principalmente durante los procesos energéticos como la respiración y la fotosíntesis, se utilizan en cantidad de reacciones de síntesis como la propia replicación del DNA o la síntesis proteica.
• Enzimas
Una característica de los seres vivos es su capacidad para llevar a cabo reacciones químicas a gran velocidad a temperatura ambiente. Si estas mismas reacciones se realizaran fuera de la célula (in Vitro) lo harían muy lentamente. La mayoría de las reacciones químicas solamente se realizan a temperaturas elevadas y, como todos los sistemas vivos requieren de un número muy elevado de reacciones químicas para mantenerse como tales y al mismo tiempo no soportan la elevada temperatura (principalmente porque se desnaturalizan sus proteínas), la única manera de realizarlas es mediante el uso de enzimas. Las enzimas son un tipo de proteínas sintetizadas por los seres vivos que catalizan (aceleran o retardan) una reacción química termodinámicamente posible.
Las enzimas pueden trabajar en concentraciones muy bajas, y eso representa una ventaja para los sistemas vivos, ya que normalmente no requieren de una alta concentración de ellas para catalizar sus vitales reacciones químicas. Sin embargo, su naturaleza proteica les confiere especificidad, lo que quiere decir que solamente catalizan un tipo de reacción, por lo que se necesita de miles de enzimas diferentes para poder realizar todas sus reacciones. Por su misma naturaleza proteica se ven afectadas en su actividad catalítica por la acción del pH, el calor, y disolventes orgánicos que pueden desnaturalizarlas. Clasificación. Las enzimas se pueden clasificar de diferentes maneras, pero la clasificación internacional se puede ver en el cuadro 1.

1. Enzimas oxidorreductasas. Intervienen en los procesos de oxidación fisiológica. Estas enzimas emplean como aceptores de hidrógeno a los nucleótidos de piridina NAD (nicotinamida adenina dinucleótido), al NADP (nicotinamida adenina dinucleótido fosfato), al FAD (flavina adenina dinucleótido) o al O2.
2. Transferasas. Se encargan de catalizar la transferencia de grupos químicos de un sustrato a otro. Un ejemplo de este tipo de enzimas es la transaminasa, que transfiere grupos amino de una molécula a otra.
3. Hidrolasas. Catalizan reacciones hidrolíticas y entre ellas se encuentran las enzimas digestivas como la amilasa, sacarasa, lipasa y proteasa.
4. Liasas. Son enzimas que rompen ligaduras entre carbonos, entre carbono y oxígeno y entre carbono y nitrógeno además de otros enlaces por medios diferentes a la hidrólisis y a la oxidación. En las reacciones de las liasas intervienen numerosas coenzimas.
5. Isomerasas. Catalizan reacciones en las que una molécula sustrato se convierte en un isómero.
6. Ligasas. Catalizan la unión de dos moléculas, utilizando energía del ATP. Nomenclatura. Para darle nombre a una enzima, se utiliza el nombre del sustrato sobre el que actúa, añadiendo el sufijo asa. Por ejemplo; la amilasa que actúa sobre el almidón, las lipasas que actúan sobre los lípidos y las proteasas que actúan sobre las proteínas. En algunos casos se les ha dado nombre en épocas un tanto remotas que no siguen esta nomenclatura, pero que son generalmente empleados, como en el caso de la pepsina y tripsina (enzimas digestivas), por lo cual se ha establecido una nomenclatura y clasificación sistemática por parte de la International Enzyme Comission, que se emplea más en las publicaciones científicas, o cuando se requiere de una identificación exacta. Para el uso común es más práctica la nomenclatura primeramente descrita.
Características de las enzimas. Desde el punto de vista estructural hay dos tipos de enzimas: las que son proteínas puras y las que están compuestas por una parte proteica llamada apoenzima y que constituye la enzima propiamente dicha; pero que para su activación requiere de un cofactor. El cofactor puede ser de cualquiera de los tres tipos siguientes:
a) Grupo prostético El grupo prostético es un cofactor no proteico que se encuentra unido por enlace covalente a la parte proteica, convirtiéndola así en una heteroproteína o proteína conjugada.
b) Coenzima. Esta es una molécula de naturaleza orgánica, pequeña, termoestable, y que se puede separar fácilmente de la parte proteica, pero que, no obstante, participa de la actividad enzimática. La parte proteica recibe el nombre de apoenzima, y su complementación con la coenzima recibe el nombre de holoenzima.
c) Activador metálico. Estos son cationes metálicos mono o bivalentes, tales como K+, Mn2+, Mg2+, Ca2+, Zn2+ que pueden estar débil o fuertemente adheridos a la enzima. Cuando se separa a la apoenzima de su cofactor, ésta permanece inactiva. La mayoría de las enzimas son de este último tipo y recibe el nombre de holoenzima cuando la apoenzima está unida a su cofactor (figura 1).
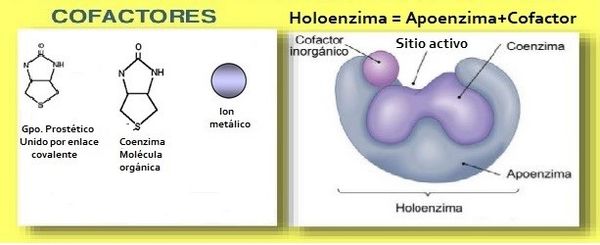
Entre las características de las enzimas, existen cuatro que todas comparten:
1) Únicamente catalizan reacciones termodinámicamente posibles, pero lo hacen a gran velocidad.
2) Las enzimas no se ven alteradas permanentemente a consecuencia de las reacciones que catalizan, por lo cual la misma enzima puede catalizar innumerables veces la reacción.
3) La misma enzima puede trabajar en la reacción inversa.
4) Las enzimas son altamente específicas y actúan únicamente sobre un sustrato.
Interacción Enzima-sustrato.
Como ya se mencionó, la dinámica celular depende de que se realicen un sinnúmero de reacciones bioquímicas, las cuáles son catalizadas por las enzimas; así, se dice que el sustrato es la sustancia sobre la que actúa, y se trata de moléculas que la enzima puede reconocer químicamente, unirse a ellas y actuar para catalizar una reacción específica. Ya que las enzimas son específicas para un sustrato, se debe tener un mecanismo de reconocimiento del sustrato a catalizar. Dicho mecanismo consiste en una porción de la molécula enzimática llamado “sitio activo” (figura 1). Este sitio suele consistir en un grupo de aminoácidos específicos.
La manera como se constituye el complejo enzima – sustrato ha sido explicado por Emil Fischer (1980) a través de un modelo denominado llave – cerradura, el cual propone que el sustrato encaja en la enzima como una llave en cerradura; es decir, debe haber una complementación tridimensional entre ambos (ver figura 2.).
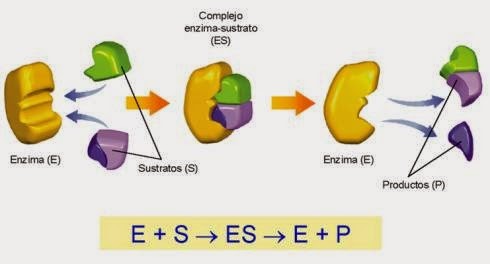
Factores que afectan la actividad enzimática.
Las condiciones físico químicas en las que se desenvuelva una enzima dependerán del órgano y tipo celular donde se encuentre, así como la función que realice; así, tenemos que en cuanto a condiciones medioambientales, la temperatura y el pH desempeñarán un papel primordial en la velocidad de reacción; mientras que otros factores que también afectan la dinámica de la reacción, son la concentración tanto de la enzima como del sustrato, así como la presencia de sustancias inhibidoras, tanto competitivas como no competitivas.
Concentración de la enzima. Normalmente la velocidad de la reacción catalizada es directamente proporcional a la concentración de la enzima. A mayor cantidad de enzima presente en un mismo tiempo, se obtiene una mayor cantidad de producto cuando se tiene una cantidad ilimitada de sustrato (figura 3).
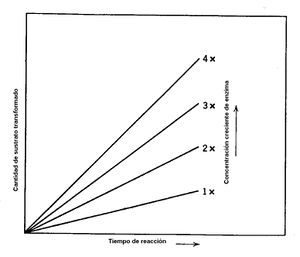
Concentración del sustrato. Ante una cantidad fija de enzima, si variamos la cantidad de sustrato, la cantidad de producto (s) se incrementa hasta cierto límite, donde se mantiene sin importar una mayor adición de sustrato (ver figura 4)
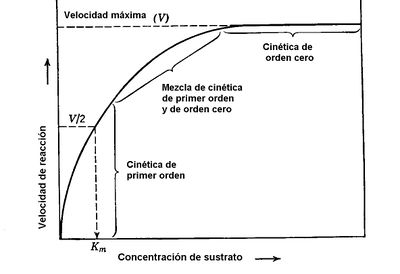
Efecto de la temperatura. Desde la época de Louis Pasteur es bien sabido que el calor inhibe la actividad vital. En efecto, en la época actual sabemos que el calor puede cambiar la estructura de las proteínas enzimáticas al modificar su estructura, y por lo tanto el sitio activo, lo cuál cancela su posibilidad catalizadora, la cual, llegado cierto punto es irreversible. También sabemos que las enzimas tienen un rango de temperatura en la que pueden funcionar adecuadamente; y en efecto, las temperaturas cercanas al punto de congelación (0°C), la velocidad de reacción es baja y se incrementa conforme la temperatura sube; esto hasta cierto grado, pues si se rebasa por mucho la temperatura de 36°C típica de los homeotermos (organismos que mantienen constante su temperatura corporal, como aves y mamíferos), las proteínas empiezan a dañarse y la velocidad de reacción decae. Un humano puede morir cuando su temperatura interna alcanza los 440 C (ver figura 5).
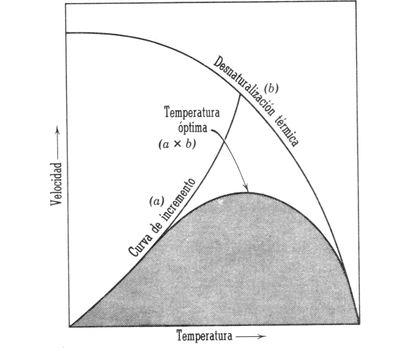
Una vez que una enzima ha sido dañada por altas temperaturas ya no se puede volver nuevamente funcional. Esta es la razón por la que es más seguro comer alimentos cocinados que crudos, ya que, al cocinarse, las altas temperaturas inactivan las enzimas de los microorganismos presentes y éstos mueren. A diferencia de las altas temperaturas, las temperaturas bajas no producen daño permanente a las enzimas, usualmente al bajar la temperatura la actividad enzimática disminuye y hasta puede detenerse, pero al aumentar la temperatura la enzima puede volver a activarse.
Efecto del pH. La acidez o alcalinidad del medio en el que se encuentre una enzima puede afectar sus propiedades catalíticas. Sabemos que el pH neutro es de 7, y que cualquier valor por debajo de 7 corresponde a un medio ácido. Así, los valores ácidos van del 0 al 7; entre más ácida es una solución su pH será más bajo. Por arriba de 7 y hasta un valor de 14 tenemos los pH alcalinos; entre más alto el valor del pH por arriba de 7, más alcalina es la solución.
Debido a que las enzimas son proteínas, éstas se pueden ver afectadas en sus grupos amino y carboxilo que son de carácter iónico, y, en consecuencia, modificar sus propiedades catalíticas. Un alto nivel de acidez o alcalinidad pueden producir desnaturalización de las proteínas; así, la velocidad de reacción de las enzimas decae tanto a pH ácido, como alcalino, y aunque existen importantes excepciones, en general el pH óptimo para la actividad enzimática es cercano a 7 (figura 6).
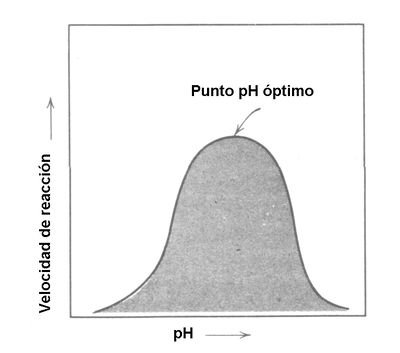
En las células existen sustancias amortiguadoras del pH que evitan que el citoplasma se acidifique o alcalinice y lo mantienen en un pH adecuado o muy cercano a él. Al igual que las bajas temperaturas el pH ácido puede ser usado para conservar alimentos (por ejemplo; en vinagre, que es ácido acético), ya que las enzimas de los microbios que descomponen los alimentos no pueden tolerar las condiciones ácidas.
Inhibición enzimática.
La inhibición enzimática se produce cuando una molécula que no es el sustrato normal con el que funciona la enzima es capaz, debido a similitud molecular, de combinarse con la enzima, boqueando su actividad catalítica. Se han identificado dos clases de inhibición: a) Por competencia y b) No competitiva.
Inhibición competitiva. Se da cuando un compuesto compite, ya sea con el sustrato o con la coenzima para ocupar el sitio activo de la enzima. Se le llama competitiva porque al ocupar la molécula inhibidora el sitio activo, ésta puede ser desplazada al aumentar la cantidad de sustrato. Las moléculas más abundantes (sustrato o inhibidora) serán las que ocupen el sitio activo. Por ejemplo; la deshidrogenasa succínica oxida rápidamente el ácido succínico transformándolo en fumárico. Si se agregan concentraciones crecientes de ácido malónico, cuya estructura molecular es muy parecida a la del ácido succínico, la deshidrogenasa reduce considerablemente su actividad. Esta inhibición es reversible, ya que basta con aumentar la concentración de ácido succínico para que reaparezca la actividad enzimática.
Inhibición no competitiva. Se da cuando el inhibidor, una vez que ocupa el sitio activo de la enzima, no puede ser desplazado al aumentar la concentración de sustrato, ya que el inhibidor se adhiere fuertemente a un punto de la superficie enzimática de donde ya no se separa. Los inhibidores competitivos se unen a un sitio distinto al sitio activo de la enzima, a menudo deformando la enzima, de manera que ésta no forma parte del complejo enzima-sustrato; además, una vez formado el complejo enzima-sustrato no se descompone a la velocidad necesaria para suministrar los productos.
Los inhibidores competitivos tienen múltiples usos; por ejemplo, en medicina se emplean para inhibir algunas enzimas bacterianas. Las sulfas se le han suministrado a personas con el fin de atacar a las bacterias capaces de producir enfermedades: desde infecciones en las vías urinarias hasta neumonía. Las sulfas bloquean en las bacterias la transformación del ácido para-aminobenzoico en la esencial coenzima ácido fólico, que es una vitamina (figura 7). La sulfa ocupa el sitio activo de la enzima e inhibe la producción del ácido fólico, que es esencial para la bacteria.
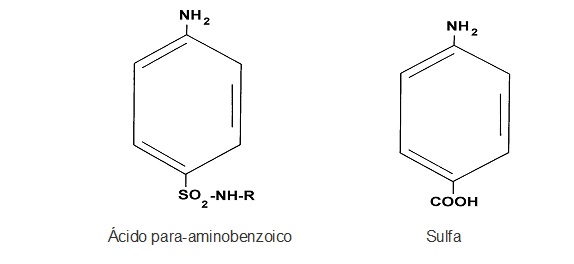
Como las bacterias ahora son incapaces de producir el ácido fólico dejan de proliferar, ya que sus reacciones enzimáticas dependen de esta coenzima. A nosotros no nos afectan las sulfas, aunque requerimos del ácido fólico, pero nuestro organismo no lo fabrica pues lo obtenemos de la dieta.
Existen otros tipos de inhibición como la alostérica, en la que sustancias diversas afectan la estructura cuaternaria de la enzima, o el caso de algunos metales pesados (por ejemplo, plomo, arsénico o mercurio), que también alteran la forma, y por lo tanto la actividad catalítica.
Rutas Metabólicas
Como hemos visto, por su estructura primordialmente proteica, las enzimas son los agentes a través de los cuales el DNA controla la mayor parte de la actividad de los sistemas vivos. No obstante, rara vez la formación o degradación de sustancias en dichos sistemas vivientes son de un solo paso con una sola enzima implicada en el proceso. En efecto, la obtención de sustancias complejas, o, por el contrario, la degradación de sustancias complejas a simples, por lo general requieren de una serie de reacciones secuenciales en donde cada reacción es catalizada por una enzima específica. La serie de reacciones que llevan de unos reactivos a ciertos productos finales, se llaman rutas metabólicas.
Es común comparar las rutas metabólicas con la producción industrial en serie, donde en el paso A se hace determinado montaje a partir del cual, en el siguiente paso B, se parte de A; mientras que el paso C requiere de que el paso B se haya cumplido. En este caso, la enzima 1 cataliza cierta reacción generando un producto que a su vez sirve de sustrato para la enzima 2 y así sucesivamente:
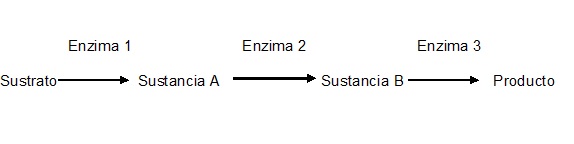
Teóricamente, cualquiera de estas reacciones es reversible, por lo que para que la ruta metabólica fluya como en el esquema, se requiere de ciertas condiciones de concentración de los sustratos de cada una de las enzimas implicadas en el proceso. Es decir, debe haber una mayor concentración de sustrato que de la sustancia A, que a su vez debe estar más concentrada que la sustancia B y así sucesivamente.
Por otra parte, no todas las rutas metabólicas son lineales; con frecuencia ocurre que se encuentran bifurcadas:
El control de la mayoría de estas reacciones es de tipo alostérico. Es decir, los productos son capaces de bloquear su propia producción uniéndose y bloqueando a la enzima cuando su concentración llega a cierto límite
ORIGEN DE LAS FIGURAS.
Figura 1. Modificado de: https://www.eluniversal.com.mx/articulo/deportes/futbol/2015/08/23/que-pumas-no-sea-flor-de-un-solo-dia Consulta: 13/01/2019
Figura 2. https://www.quora.com/What-are-the-differences-between-ATP-and-ADP Consulta: 13/01/2019
Figura 3. Modificada de: https://www.istockphoto.com/mx/vector/ciclo-de-atp-adp-transferencia-de-energ%C3%ADa-intracelular-gm1071481764-286743304 Consulta: 13/01/2019
Figura 1. Imagen original de los autores.
Figura 2. www.whatsthatbug.com Consulta: 13/01/2019
Figura 3 www.lingote.site50.net Consulta: 13/01/2019
Figura 4. www. medicina4all.wordpress.com Consulta: 13/01/2019
Figura 5. www: genesis.uag.mx Consulta: 13/01/2019
Figura 6. www.genomasur.com Consulta: 13/01/2019
Figura 7. www.kimiexplorer.wikispaces.com Consulta: 13/01/2019
Figura 8. www.estonoescomida.com Consulta: 13/01/2019
Figura 9. www.um.es Consulta: 13/01/2019
Figura 10. www.geocities.ws Consulta: 13/01/2019
Figura 11. https://www.google.com/search?q=guacamayas+volando&client=firefox-b-d&source=lnms&tbm=isch&sa=X&ved=0ahUKEwiDtrjvj-rhAhUHca0KHYw_CS0Q_AUIDigB&biw=1760&bih=886#imgrc=U7C-QNdpIHEb6M: Consulta: 13/01/2019
Figura 12. http://www.aula2005.com/html/cn3eso/15endocri/15endocries.htm Consulta: 13/01/2019
Figura 13. http://www.actualidadganadera.com/biomont/articulos/tracto-digestivo-del-ternero-lactante-y-absorcion-de-vitaminas-liposolubles.html Consulta: 13/01/2019
Figura 14. Modificado de: https://acidoclorhidrico.org/fosfato-de-calcio/ Consulta: 13/01/2019
Figura 15. https://diferencias.eu/entre-ribosa-y-desoxirribosa/ Consulta: 13/01/2019
Figura 16. Modificado de: https://www.acidosnucleicos.net/bases-nitrogenadas/ Consulta: 13/01/2019
Figura 17. a) Modificado de: https://www.ucm.es/data/cont/media/www/pag-56185/02-Estructura%20de%20los%20%C3%A1cidos%20nucl%C3%A9icos.pdf Consulta: 13/01/2019
b) Modificado de: https://es.slideshare.net/calislauri/metabolismo-de-los-nucleotidos-de-purina-y-pirimidina Consulta: 13/01/2019 Cuadro 1. 3. 1.
Figura 1. Modificado de: https://docplayer.es/44054825-Bloque-i-proteinas-y-enzimas.html y https://slideplayer.es/slide/12810991/ Consulta: 13/01/2019
Figura 2. http://apuntesbiotecnologiageneral.blogspot.com/2014/09/como-se-descubrieron-las-enzimas.html Consulta: 13/01/2019
Figura 3. Modificado de: https://slideplayer.es/slide/5506411/ Consulta: 13/01/2019
